
题目列表(包括答案和解析)
(Ⅰ)下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)其中标示出仪器使用温度的是________(填写编号).
(2)能够用以精确量取液体体积的是________(填写编号).
(3)在读取a,b仪器内液体的体积时,俯视得到的数据比正确数据偏小的是________(填写编号).
(4)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为________g.
(Ⅱ)(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式:________.
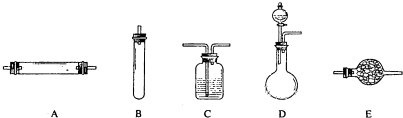
(2)试用如图中所列各装置设计一个实验,验证上述反应所产生的各种产物.

这些装置的连接顺序(按产物气流从左至右的方向)是(填编号):________→________→________→________.
(3)实验室可观察到的装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是________,B瓶溶液的作用是________,C瓶溶液的作用是________.
(4)装置②中所加的固体药品是________,可确定的产物是________,确定装置②在整套装置中位置理由是________.
(5)装置③中所盛溶液是________,可验证的产物是________.
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(1)该实验应选用 作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是 。
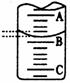 (2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,C处的刻度为26,滴定管中液面读数应为 mL,此时滴定管中液体的体积
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,C处的刻度为26,滴定管中液面读数应为 mL,此时滴定管中液体的体积
mL。
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴无气泡,滴定结束有气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C= 。
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围 (PH) | 5.0-8.0 | 3.1-4.4 | 4.4-6.2 | 8.2-10.0 |
(1)该实验应选用 作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是
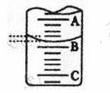 (2)右图表示50ml滴定管中液面的位置,若A与C刻度间相差1ml,A处的刻度为25,滴定管中液面读数为 ml。此时滴定管中液体的体积 。
(2)右图表示50ml滴定管中液面的位置,若A与C刻度间相差1ml,A处的刻度为25,滴定管中液面读数为 ml。此时滴定管中液体的体积 。
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为Vml,NaOH标准液浓度为C mol/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/ml | 26.02 | 25.32 | 25.28 |
从上表可以看出,第一次实验中记录消耗NaOH溶液体积明显多于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(可以不必化简):
(酸度:每100ml溶液中含有溶质酸的质量,单位:g/100ml)

| Cu |
| △ |
| Cu |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com