
题目列表(包括答案和解析)
目前测定空气中SO2含量主要用氧化还原反应。已知SO2气体与酸性KMnO4溶液反应时,MnO4-被还原为Mn2+,SO2被氧化成SO42-。为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:

①其中: 或
或 表示密闭容器;
表示密闭容器; 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
②酸性KMnO4溶液体积为200 mL,浓度为0.1 mol·L-1。
回答下列问题:
(1)配制200 mL 0.1 mol·L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有________、________、________、玻璃棒、________、________。玻璃棒的作用是
____________________________________________________________。
(2)写出并配平测定SO2含量的离子方程式:_______________________________________。
(3)实验中棉花的作用是_____________________________________________________;
若要测定空气中可吸入颗粒的含量(g·L-1),还需要测出的数据是________。
(4)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误):____________________________________________________。

 或
或 表示密闭容器;
表示密闭容器; 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。中央电视台从2001年6月5日起每天都要报道47个重点城市的空气质量预报。包括SO2和可吸入颗粒的含量。目前测定空气中SO2含量主要用氧化还原反应法。假如给你气体流速管(单位时间内通过气体的体积恒定但无除尘和吸收气体的作用)“¤”、密闭容器“□”、敞口仪器“∪”、导管“-或 、0.0001mol?L-1的酸性高锰酸钾溶液、颗粒吸附剂、品红试液、pH试纸等仪器和药品,请设计一个实验装置,测定你所在地区空气中SO2和可吸入颗粒的含量。已知5SO2+2H2O+2MnO4-(紫色)=5SO42-+2Mn2+(无色)+4H+。环境空气质量标准如下:
、0.0001mol?L-1的酸性高锰酸钾溶液、颗粒吸附剂、品红试液、pH试纸等仪器和药品,请设计一个实验装置,测定你所在地区空气中SO2和可吸入颗粒的含量。已知5SO2+2H2O+2MnO4-(紫色)=5SO42-+2Mn2+(无色)+4H+。环境空气质量标准如下: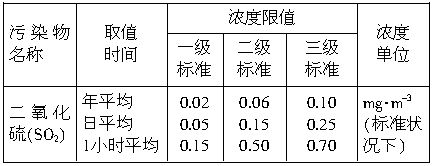
(1)画出测定空气中SO2和可吸入颗粒的含量的实验装置图(并指出仪器中的药品)。
(2)若气体流速管中气体流速为5000cm3?min-1,当140min时20mL0.0001mol?L-1的酸性高锰酸钾溶液恰好退色,则根据我国空气质量标准和测定结果判断所测定地点的空气中SO2的含量属于_________(填数字)级标准(环境)。
(3)若要测定空气中可吸入颗粒的含量,需要测出的数据有__________________________________。
现有药品:0.1mol/L的酸性KMnO4溶液、颗粒吸附剂、品红试纸、pH试纸。
(1)配置250mL0.1mol/L的酸性KMnO4溶液需要用到的仪器有__________________、__________________、玻璃棒、胶头滴管、烧杯等,玻璃棒的作用是________________和________________。
(2)在测定SO2含量和可吸入颗粒的含量时,首先应测定________________,因为__________________________。
(3)写出SO2与酸性KMnO4溶液反应的离子方程式:_________________________________。
(4)若气体的流速为acm3/min,当tmin时,200mL0.1mol/L的酸性KMnO4溶液恰好完全褪色,则空气中的SO2的含量为___________g/cm3。
 2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol
2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com