
题目列表(包括答案和解析)
(10分)已知X、Y、Z是阳离子,K是阴离子,M、N是分子。它们都由短周期元素组成,且具有以下结构特征和性质:
①它们的核外电子总数都相同;
②N溶于M中,滴入酚酞,溶液变红;
③Y和K都由A.B两元素组成,Y核内质子数比K多2个;
④X和N都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热条件下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量含K的溶液,有白色沉淀生成,再加入过量的含K或Y的溶液,沉淀消失。
回答下列问题:
(1)Y的化学式为 ;N的电子式为
(2)试比较M和N的稳定性:M (填“>”或“<”)N。
(3)写出Z和N的水溶液反应的离子方程式: ;
(4))上述六种微粒中的两种可与硫酸根形成一种含三种离子的盐,向该盐的浓溶液中逐滴加入0.1 的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
①写出b阶段的离子方程式:
②根据图像判断该盐的化学式为 。
(10分).已知某纯碱试样中含有杂质氯化钠,为测定试样中纯碱的质量分数,可用下图装置进行实验。

主要步骤如下,请填空:
① 按图组装仪器,并检查装置的气密性② 将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;③ 称量盛有碱石灰的U形管的质量为b g;④ 从分液漏斗中滴入6mol/L的稀硫酸,直到不再产生气体为止,⑤ 从导管A处缓缓鼓入一定量的空气;⑥ 再次称量盛有碱石灰的U形管的质量为c g;⑦ 重复⑤和⑥的操作,直到U形管的质量基本不变,测得质量为d g。
回答下列问题:(碱石灰是一种干燥剂,不能干燥酸性气体)
(1)装置中干燥管B的作用是
(2)如果将分液漏斗中的硫酸换成同浓度的盐酸,测试的结果将 (填偏高.偏低或不变)
(3)步骤⑤的目的是
(4)步骤⑦的目的是
(5)该试样中纯碱的质量分数的计算式为
(10分)已知25℃时部分弱电解质的电离平衡常数数据如下表:
 回答下列问题:
回答下列问题:
(1)物质的量浓度均为0.1mol·L一1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO
d.NaHCO3;
pH由小到大的排列顺序是_______________________(用字母表示)
(2)常温下,0.1mol·L—1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_______________(填序号)
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH—) D.c(OH-)/c(H+)
(3)体积均为l00mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数___________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。理由是:______________________________________。
(4)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中
c(CH3COO—)—c(Na+)=_______mol·L—1(填精确值),c(CH3COO-)/c(CH3COOH)=_______。
(10分)已知:2CH2=CH2+O2
 2CH3CHO,以乙烯、空气、水为原料在一定条件下能实现如下图所示的转化。
2CH3CHO,以乙烯、空气、水为原料在一定条件下能实现如下图所示的转化。
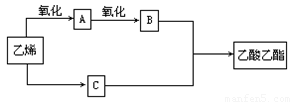
(1)物质C俗称_________ ,其结构简式为____________ ;
(2)写出由A→B的化学方程式____________________________;
(3)写出由B+C→乙酸乙酯的化学方程式____________________ 该反应是___________反应。
(10分)已知葡萄中含有酒石酸。酒石酸的化学分析如下:①相对分子质量不超过150,完全燃烧后只生成CO2和H2O,分子中C、H质量分数分别为w(C)=32%和w(H)=4%;②1 mol该酸与足量的NaHCO3反应放出44.8 L CO2,与足量的Na反应放出44.8 L H2(气体体积均已折算为标准状况);③该分子中存在二种化学环境不同的碳原子,三种化学环境不同的氢原子。回答下列问题:
(1)酒石酸的分子式为 ,分子中有________个羧基和________个羟基。
(2)写出酒石酸的结构简式____________________________。
(3)酒石酸的同分异构体中,符合上述①、②两个条件的有(写出结构简式):
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com