
题目列表(包括答案和解析)
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是_________________(填分子式)。产生这种结果的主要原因是(用离子方程式表示)_________________。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行认真探究。
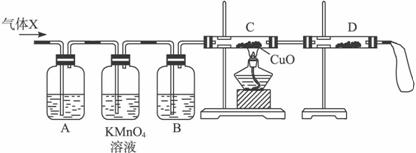
①组装好仪器后,盛放药品前,必要的一个操作是__________________________________。
②A中加入的试剂可能是____________,作用是__________________________________。
B中加入的试剂可能是____________,作用是____________________________________。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是____________________,D中最好选择的试剂是_________________。
(3)假定气体在吸收过程中吸收完全,对上述装置略加改进,可以粗略测定气体X中SO2的体积分数。改进时可选用的下列仪器为_________________(填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是__________(填分子式)。产生这种结果的主要原因足(用离子方程式表示) ______________________。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学没计了如下实验,对气体X取样进行认真探究。
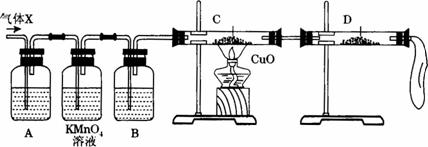
①组装好仪器后,盛放药品前,必要的一个操作是___________________________________。
②A中加入的试剂可能是__________________,作用是____________________________。
B中加入的试剂可能是____________________,作用是____________________________。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是______________,D中最好选择的试剂是______________________。
(3)假定气体在吸收过程中吸收完全,对上述装置略加改进,可以粗略测定气体X中SO2的体积分数。改进时可选用的下列仪器为__________________(填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
某化学兴趣小组需制备22.4 LSO2气体(标准状况),他们依据化学方程式Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是(用离子方程式表示) 。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体(X)取样进行认真探究。
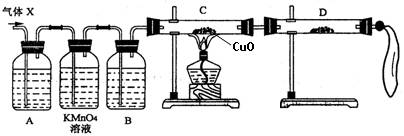
①组装好仪器后,盛放药品前,必要的一个操作是 。
②A中加入的试剂可能是 ,作用是 。
B中加入的试剂可能是 ,作用是 。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是 ,D中最好选择的试剂是 。
(3)假定气体在吸收过程吸收完全,对上述装置略加改进,可以粗略测定X气体中SO2的体积分数。改进时可选用的下列仪器为 (填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
 ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。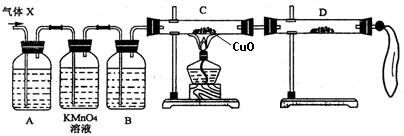
(15分)随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g) + CO2(g) +2H2O(g) ⊿H= -574 kJ·mol-1
②CH4(g) +4NO(g)=2N2(g) + CO2(g) + 2H2O(g) ⊿H=-1160 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 。
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
|
浓度/mol·L-1
|
NO |
N2 |
CO2 |
|
0 |
1.00 |
0 |
0 |
|
10 |
0.58 |
0.21 |
0.21 |
|
20 |
0.40 |
0.30 |
0.30 |
|
30 |
0.40 |
0.30 |
0.30 |
|
40 |
0.32 |
0.34 |
0.17 |
|
50 |
0.32 |
0.34 |
0.17 |
①10min~20min以v(CO2) 表示的反应速率为 。
②根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变 B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是 。请在右图中画出30min至40min 的变化曲线。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com