
题目列表(包括答案和解析)
(12分)(1)氢能源是21世纪极具有发展前景的新能源之一,它既是绿色能源,又可循环使用。请在下图的每个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在):
①_____,②_____。从能量转换的角度看,过程Ⅱ应是____能转化为_____能。

(2)图中的燃料电池也可以用A和氧气为原料。已知A分子是由碳和氢两元素的原子构成,并且8.00 g A中含有3.01×1023个分子。实验测得在298 K时,1 mol该气体完全燃烧生成液态水和二氧化碳,放出890 kJ的热量。
①写出该气体的化学式:______。
②写出1 mol该气体燃烧时的热化学反应方程式:_____________。
③已知1 mol液态的水变成气态水时需要吸收44 kJ的热量,则1 mol该气体完全燃烧生成气态水和二氧化碳时放出的热量为________kJ。
④若该燃料电池中的电解质溶液为氢氧化钾溶液,则:电池正极反应为______________。
(12分)(1)氢能源是21世纪极具有发展前景的新能源之一,它既是绿色能源,又可循环使用。请在下图的每个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在):
①_____,②_____。从能量转换的角度看,过程Ⅱ应是____能转化为_____能。
(2)图中的燃料电池也可以用A和氧气为原料。已知A分子是由碳和氢两元素的原子构成,并且8.00 g A中含有3.01×1023个分子。实验测得在298 K时,1 mol该气体完全燃烧生成液态水和二氧化碳,放出890 kJ的热量。
①写出该气体的化学式:______。
②写出1 mol该气体燃烧时的热化学反应方程式:_____________。
③已知1 mol液态的水变成气态水时需要吸收44 kJ的热量,则1 mol该气体完全燃烧生成气态水和二氧化碳时放出的热量为________kJ。
④若该燃料电池中的电解质溶液为氢氧化钾溶液,则:电池正极反应为______________。
| ||
| ||
 (2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
(2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
| ||
| △ |

| c2(SO3) |
| c2(SO2)c(O2) |
| c2(SO3) |
| c2(SO2)c(O2) |
| 实验次数 | 铵盐质量(g) | 浓硫酸增加的质量(g) |
| 第一次 | 1.570 | 0.340 |
| 第二次 | 3.140 | 0.680 |
| 第三次 | 4.710 | 0.510 |
| 第四次 | 6.280 | 0 |
(12分)钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg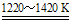 Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)Ti元素原子的价电子排布式为_____________________。
(2)与CO互为等电子体的分子是___________。
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
① TiCl4为______化合物(填“离子”或“共价”)。
② TiCl4分子为正四面体形,则Ti为________杂化。
③ TiCl4在潮湿空气中水解的化学方程式是_____________________________________。
④TiO2、Cl2和C反应制得的TiCl4最好的提纯方法是____________ (填操作名称)。
(4)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,中心离子配位数为 。
(12分)以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
|
难溶物 |
Ksp |
|
Ca3(AsO4)2 |
6.8×10-19 |
|
AlAsO4 |
1.6×10-16 |
|
FeAsO4 |
5.7×10-21 |
表1.几种砷酸盐的Ksp
|
污染物 |
H2SO4 |
As |
|
浓度 |
28.42 g/L |
1.6 g·L-1 |
|
排放标准 |
pH 6~9 |
0.5 mg·L-1 |
表2.工厂污染物排放浓度及允许排放标准
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=______________mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=______________,若混合溶液
中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是_______________mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化
成五价砷(H3AsO4弱酸),写出该反应的离子方程式________________________________。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH
调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为______________;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为_____________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com