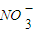在氧化还原反应中,氧化过程和还原过程是同时发生的两个半反应.Cu
2O-2e
-+2H
+═2Cu
2++H
2O是一个半反应式.下列五种物质FeSO
4、Fe
2(SO
4)
3、CuSO
4、Na
2CO
3、KI中的一种能使上述半反应顺利发生.
(1)写出并配平该氧化还原反应的离子方程式:______.
(2)向(1)中反应后的溶液里加入酸性高锰酸钾溶液,得还原产物Mn
2+(无色),反应的离子方程式为______;判断Cu
2+、MnO
-、Fe
3+的氧化性由强到弱的顺序是______(用离子符号表示).
(3)某同学用上述原理测定一种含Cu
2O的矿石中Cu
2O的质量分数:称量5.0g矿石溶于足量的硫酸铁和硫酸的混合溶液中,充分反应后,用酸性高锰酸钾溶液滴定,消耗0.100 0mol?L
-1的高锰酸钾溶液的体积为100.00mL.
①滴定时,滴定终点的颜色为______.
②该同学测得矿石样品中Cu
2O的质量分数为______.
③下列情况使测定结果一定偏高的是______.
A.开始和终点都是仰视读数
B.没有用待装液润洗滴定管
C.称量时,砝码与样品放反了
D.样品中含有较强还原性杂质
E.高锰酸钾溶液中含有
NF.用酸性高锰酸钾溶液润洗锥形瓶.