
题目列表(包括答案和解析)
下图所示为白磷在空气中充分燃烧后,生成物分子的结构示意图.其中圆圈表示原子,实线表示化学键.下列关于该生成物的叙述中不正确的是
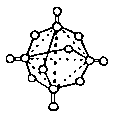
[ ]
A.生成物的化学式为P4O10
B.分子中磷原子排列成正四面体型
C.单实线表示的化学键为极性键,双实线表示的为非极性键
D.分子中每个磷原子都处于一个正四面体的中心
|
如图所示为白磷在空气中充分燃烧后,生成物分子的结构示意图.其中圆圈表示原子,实线表示化学键.下列关于该生成物的叙述中不正确的是
| |
| [ ] | |
A. |
生成物的化学式为P4O10 |
B. |
分子中磷原子排列成正四面体型 |
C. |
单实线表示的化学键为极性键,双实线表示的为非极性键 |
D. |
分子中每个磷原子都处于一个正四面体的中心 |
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为P4(s,白磷)+5O2(g)=P4O10(s)ΔH1=-2 983.2 kJ·mol-1;P(s,红磷)+ O2(g)=
O2(g)=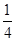 P4O10(s)ΔH2=-738.5 kJ·mol-1,则该温度下白磷转化为红磷的热化学方程式为________________。
P4O10(s)ΔH2=-738.5 kJ·mol-1,则该温度下白磷转化为红磷的热化学方程式为________________。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)=P4O6(s)ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________,反应过程中放出的热量为________。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。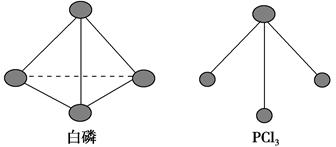
则反应P4(s,白磷)+6Cl2(g)=4PCl3(s)的反应热ΔH=________。
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为P4(s,白磷)+5O2(g)=P4O10(s)ΔH1=-2 983.2 kJ·mol-1;P(s,红磷)+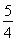 O2(g)=
O2(g)=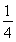 P4O10(s)ΔH2=-738.5 kJ·mol-1,则该温度下白磷转化为红磷的热化学方程式为________________。
P4O10(s)ΔH2=-738.5 kJ·mol-1,则该温度下白磷转化为红磷的热化学方程式为________________。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)=P4O6(s)ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________,反应过程中放出的热量为________。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。

则反应P4(s,白磷)+6Cl2(g)=4PCl3(s)的反应热ΔH=________。
根据所学知识,完成下列问题:
(1)化学反应可视为旧键断裂和新键生成的过程。键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和其燃烧产物P4O6的分子结构如图所示,现提供以下键能(kJ· mol-1): P-P:198, P-O:360, O-O:498,白磷(P4)燃烧的热化学方程式为 。
(2)化学能与电能之间可以相互转化,以Fe、Cu、C(石墨)、CuSO4溶液、FeSO4溶液、Fe2(SO4)3溶液 、AgNO3溶液为原料,通过原电池反应实现2Fe3+ + Cu=2Fe2+ + Cu2+,请你把下图补充完整,使之形成闭合回路,并用元素符号标明电极。甲池中电解液是 溶液;乙池中电解液是 溶液。(要求:甲、乙两池中电解质元素种类始终保持不变)
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
①对PM2.5空气样本用蒸馏水处理,制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/ mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
 2NO(g)
2NO(g) 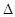 H>0
H>0湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com