
题目列表(包括答案和解析)
已知2KCl(固体)+H2SO4(浓)![]() K2SO4+2HCl↑,则实验室用该原理制取HCl的发生装置与实验室制 氯气 (填气体名称)相同,将制和HCl气体溶于水即得盐酸,吸收时用倒置的漏斗。现用实验室 O2(以KClO3为原料,MnO2作催化剂)的残渣为原料,先制得HCl,再制取Cl2。
K2SO4+2HCl↑,则实验室用该原理制取HCl的发生装置与实验室制 氯气 (填气体名称)相同,将制和HCl气体溶于水即得盐酸,吸收时用倒置的漏斗。现用实验室 O2(以KClO3为原料,MnO2作催化剂)的残渣为原料,先制得HCl,再制取Cl2。
(1)某学生提出的实验步骤依次是:溶解、蒸发、结晶、制气体。其中还缺少的必要步骤是 ;
(2)某学生开列的实验用品为:烧杯、圆底烧瓶、蒸发皿、量筒、集气瓶、分液漏斗、酒精灯、药匙、托盘天平、铁架台(含铁夹、铁圈)、双孔橡皮塞、玻璃导管、橡皮管、火柴、蒸馏水。所缺少的必要试剂是 ,还缺少的必要的实验用品是 。
(3)写出制得的HCl溶液与MnO2反应制Cl2的离子方程式: 。
(4)甲同学用51.33 g的MnO2和足量浓盐酸共热制取Cl2的质量为m g。乙同学用200 mL 36.5%的浓盐酸(ρ=1.18 g/cm3)和足量的MnO2共热制取Cl2,得到Cl2的质量为n g。砂考虑反应物的损耗的前提下,m与n的大小关系是m n(填>、<、=)。
(5)多余的Cl2吸收的装置中所用的仪器是 ,试剂是 (选填序号:A. NaOH饱和溶液,B. Ca(OH)2饱和溶液),你选择的理由是 。
(共8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| | IA | | | | | | | 0 |
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | ⑦ | | ⑧ | |
 组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。
组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。
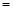 。
。工业上以软锰矿为原料,利用烧结烟气中的SO2制备MnSO4·H2O的流程如下:
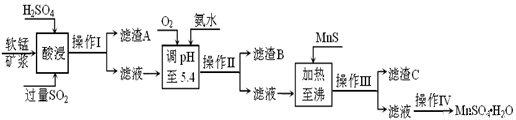
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、 Al、 Zn、 Cu等。25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥-0.42 |
≥2.5 |
≥7 |
≥7 |
回答下列问题:
(1)酸浸时SO2将MnO2还原为MnSO4,其离子方程式为 。
酸浸时SO2的吸收率与pH和温度的关系如下图,为提高SO2的吸收率,酸浸适宜的条件是 。


图1: SO2 的吸收率与 pH值的关系 图2: SO2的吸收率与温度的关系
(2)滤渣B的主要成分是 。
(3)加入MnS的目的是 。
(4)操作IV的步骤为 、 、过滤、洗涤、干燥。
(5)MnO2的生产方法之一是以石墨为电极,在不断搅拌情况下,电解酸化的MnSO4溶液,阳极的电极反应式为: 。
(6)已知金属离子浓度小于1.0×10-5mol/L时认为已经完全沉淀,根据表格数据,计算25℃时Zn(OH)2溶度积Ksp为 (不需计算过程,计算结果保留两位有效数字)。
 如右图所示,B中盛装的是一种固体物质。当A中的溶液滴入B内反应一段时间后,所得产物经装置C后可得到纯净的气体X,每个X分子中含有10个电子。D中盛装的是黑色粉末,当X气体通过D时,黑色粉末逐渐变成红色,最后从E装置中出来的气体是一种纯净的单质Y,Y在标准状况下的密度为1.25g/L。装置中A、B、C、D、E中的药品只能从下列所给试剂a~p中选择,图中某些夹持仪器未画出。
如右图所示,B中盛装的是一种固体物质。当A中的溶液滴入B内反应一段时间后,所得产物经装置C后可得到纯净的气体X,每个X分子中含有10个电子。D中盛装的是黑色粉末,当X气体通过D时,黑色粉末逐渐变成红色,最后从E装置中出来的气体是一种纯净的单质Y,Y在标准状况下的密度为1.25g/L。装置中A、B、C、D、E中的药品只能从下列所给试剂a~p中选择,图中某些夹持仪器未画出。
a.浓硫酸 b.浓硝酸 c.稀硝酸 d.浓盐酸 e.稀硫酸 f.浓氨水
g.铜片 h.锌片 i.碱石灰 j.硫酸铜 k.生石灰 l.硝酸铵晶体
m.固体烧碱 n.稀NaOH溶液 o.CuO p.MnO2
回答下列问题:
⑴C装置内的药品是 (用a~p中的字母表示),其作用是 。
⑵A中溶液和B中固体的所有可能的组合共有 种。
⑶纯净气体X通过D时,发生反应的化学方程式是 ,反应中若转移电子的物质的量为1.2mol,则D装置中黑色固体共失重 g。
⑷E中的药品是 (用a~p中的字母表示),其作用是 。
(共8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
|
IA |
|
|
|
|
|
|
0 |
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
|
⑦ |
|
⑧ |
|
(1)、④、⑤、⑥的原子半径由大到小的顺序为 (填元素符号)。
②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(2)、①、④、⑤、⑧四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(3)、由表中两种元素的原子按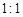 组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。
组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。
a.MnO2 b.Na2SO4 c.Na2SO3 d.CaCO3
(4)、由表中元素形成的物质X、Y、Z、M、N可发生以下反应:
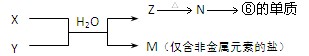
X溶液与Y溶液反应的离子方程式为 ;
常温下,为使0.1 mol/L M溶液中电离出的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至pH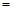 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com