
题目列表(包括答案和解析)
| ||
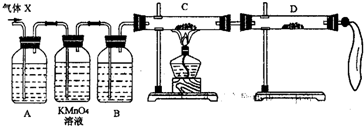
(15分)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
⑴SO2和O2反应制取SO3的反应原理为:2SO2+O2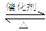 2SO3,在一密闭容器中一定时间内达到平衡.
2SO3,在一密闭容器中一定时间内达到平衡.
①该反应的平衡常数表达式为: .
②该反应达到平衡状态的标志是 .
A.v(SO2)=v(SO3) B.混合物的平均相对分子质量不变
C.混合气体质量不变 D.各组分的体积分数不变
⑵某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.
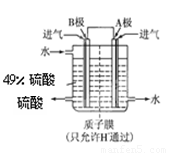
①B电极的电极反应式为 ;
②溶液中H+的移动方向由 极到 极;(用A、B表示)
⑶测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL溶液
b.量取25 mL待测液于锥形瓶中
c.用硫酸酸化的0.01 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40 mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式).
Fe2++ 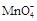 +
——
Fe3++ Mn2++
+
——
Fe3++ Mn2++
②用硫酸酸化的KMnO4滴定终点的标志是 .
③计算上述产品中FeSO4·7H2O的质量分数为 .
(15分)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
⑴SO2和O2反应制取SO3的反应原理为:2SO2+O2 2SO3,在一密闭容器中一定时间内达到平衡.
2SO3,在一密闭容器中一定时间内达到平衡.
①该反应的平衡常数表达式为: .
②该反应达到平衡状态的标志是 .
A.v(SO2)=v(SO3) B.混合物的平均相对分子质量不变
C.混合气体质量不变 D.各组分的体积分数不变
⑵某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.
①B电极的电极反应式为 ;
②溶液中H+的移动方向由 极到 极;(用A、B表示)
⑶测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL溶液
b.量取25 mL待测液于锥形瓶中
c.用硫酸酸化的0.01 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40 mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式).
Fe2++  + —— Fe3++ Mn2++
+ —— Fe3++ Mn2++
②用硫酸酸化的KMnO4滴定终点的标志是 .
③计算上述产品中FeSO4·7H2O的质量分数为 .
 ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(ρ=1.84g/cm3)110mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回.
ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(ρ=1.84g/cm3)110mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回.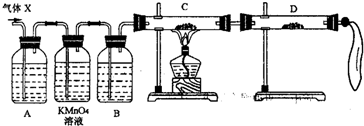
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com