
题目列表(包括答案和解析)
 室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(℃)
室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(℃)+ 4 |
| 离子浓度的关系 | 溶质 | 溶液的pH | 物料守恒关系 | |
| ① | C(NH4+)>C(Cl-)>C(OH-)>C(H+) | NH4Cl、NH3?H2O NH4Cl、NH3?H2O |
pH>7 | / |
| ② | NH4Cl | / | c(NH4+)+c(NH3?H2O)=c(Cl-) c(NH4+)+c(NH3?H2O)=c(Cl-) | |
| ③ | C(Cl-)>C(H+)>C(NH4+)>C(OH-) | NH4Cl、HCl NH4Cl、HCl |
pH<7 | / |
 某温度下,NH3?H2O的电离常数为1.6×10-5,将1.000mol?L-1的盐酸逐滴滴入20.00mL 1.000mol?L-1氨水中,溶液的pH和温度随加入盐酸体积变化曲线如图所示,下列有关说法不正确的是( )
某温度下,NH3?H2O的电离常数为1.6×10-5,将1.000mol?L-1的盐酸逐滴滴入20.00mL 1.000mol?L-1氨水中,溶液的pH和温度随加入盐酸体积变化曲线如图所示,下列有关说法不正确的是( )| A、a点:溶液的pH约为12.6 | B、b点:c(NH 4+)>c(Cl-)>c(OH-)>c(H+) | C、c点:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | D、d点后,溶液温度略下降的主要原因是NH3?H2O电离吸热 |
|
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示.下列有关说法正确的是
| |
A. |
a点由水电离出的c(H+)=1.0×10-14 mol/L |
B. |
a、b之间可能出现:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
C. |
c点:c(Cl-)=c(NH4+) |
D. |
d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表是25℃时几种常见弱酸的电离平衡常数
| 酸 | 电离方程式 | 电离平衡常数K |
| | | |
| | | |
| | | |
| | | |
回答下列各问:
(1)K只与温度有关,当温度升高时,K值________(填“增大”、“减小”、“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?__________________.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是_________,最弱的是________.
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数.对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,对于H3PO4此规律是________________,产生此规律的原因是_________________________.
![]() (5)电离平衡常数是用实验的方法测定出来的.现已经测得某温度下 NH3∙H2O溶液中存在如下反应:NH3∙H2O NH4++OH- 已知0.10 mol·L-1NH3∙H2O溶液中,达到平衡时,C平衡(OH-)=4.2 × 10-3mol·L-1,C平衡(NH3∙H2O)≈C起始(NH3∙H2O),水的电离可忽略不计;
(5)电离平衡常数是用实验的方法测定出来的.现已经测得某温度下 NH3∙H2O溶液中存在如下反应:NH3∙H2O NH4++OH- 已知0.10 mol·L-1NH3∙H2O溶液中,达到平衡时,C平衡(OH-)=4.2 × 10-3mol·L-1,C平衡(NH3∙H2O)≈C起始(NH3∙H2O),水的电离可忽略不计;
①用pH试纸测量溶液的pH值,即可求得C平衡(OH-),测定溶液pH值的操作是______________。
②测量C平衡(NH3∙H2O)的方法最好用_____________法(填方法名称)
③求此温度下该反应的平衡常数K.(写出计算过程,计算结果保留2位有效数字)
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表是25℃时几种常见弱酸的电离平衡常数
| 酸 | 电离方程式 | 电离平衡常数K |
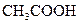 | 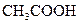  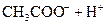 |  |
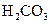 |  | 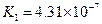 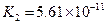 |
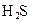 | 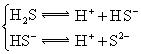 | 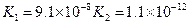 |
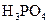 | 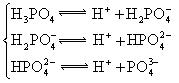 | 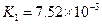 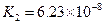 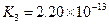 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com