(14分)氮的化合物是中学化学的重要物质,与人类生活密切相关。
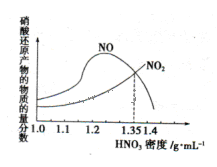
(1)金属与不同密度的硝酸溶液反应所得的还原产物比较复杂,如图所示:

请写出铁与密度为1.35 g.m

的硝酸反应的化学方程式:______________________.
(2)亚硝酸钠是一种致癌物质,它在中性或碱性条件下是稳定的,酸化后能氧化碘化钾生成棕色溶液和NO,则该反应中氧化剂与还原剂的物质的量之比为____。
(3)如图甲为NO
2和C0反应生成CO
2和NO过程的能量变化示意图,请写出该反应的热化学方程式:__________________________________________________________.
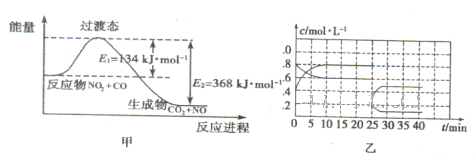
(4)已知NO
2和N
2O
4可以相互转化:2NO
2(g)

N
2O
4(g) △H<0。现将一定量的NO
2和N
2O
4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
①前10 min内用NO
2表示的平均反应速率v(NO
2)=
;上述反应的平衡常数K=__________。
②反应进行至25 min时,曲线发生变化的原因是________________________.
③若要使上述反应的平衡常数K增大,采取的措施是_________________。
| A.加入催化剂 | B.缩小容器体积 | C.降低温度 | D.再加入一定量的NO2 |


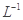 的硝酸反应的化学方程式:______________________.
的硝酸反应的化学方程式:______________________.
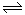 N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
 的硝酸反应的化学方程式:______________________.
的硝酸反应的化学方程式:______________________.
 N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
