实验一、定性探究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生.
经检测,上述实验中产生的无色气体均为CO
2.请回答:
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因
在饱和氯水中存在如下平衡:Cl
2+H
2O

HClO+HCl,加入过量的CaCO
3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
在饱和氯水中存在如下平衡:Cl
2+H
2O

HClO+HCl,加入过量的CaCO
3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
.
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份:
Ca2++HCO3-+OH-=CaC03↓+H2O
Ca2++HCO3-+OH-=CaC03↓+H2O
.
第二份:
HCO3-+H+=CO2↑+H2O
HCO3-+H+=CO2↑+H2O
.
(3)试根据所学知识推测,在②的滤液中含 有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式)
HClO、Ca(HCO3)2、CaCl2
HClO、Ca(HCO3)2、CaCl2
.
实验二、定量探究:
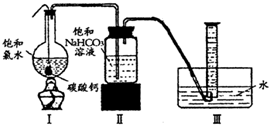
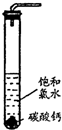
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如右图所示装置(部分夹持、支撑仪器没有画出)实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.请回答:
(4)为减少用装置Ⅲ收集气体过程中CO
2因溶解而造成的损失,水槽中的水应换为
B
B
.
A.饱和碳酸钠溶液 B.饱和碳酸氢钠溶液 C.饱和食盐水
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO
2气体BL,发现
明显小于
.若不考虑实验操作和CO
2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是
碳酸钙与氯水反应生成的Ca(HC03)2再受热时,除生成CO2外,还生成了CaC03
碳酸钙与氯水反应生成的Ca(HC03)2再受热时,除生成CO2外,还生成了CaC03
.

 I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:
I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题: H++HA- HA-
H++HA- HA- H++A2-
H++A2- 实验一、定性探究:
实验一、定性探究: HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO