
题目列表(包括答案和解析)
 2Fe2O3+8SO2
2Fe2O3+8SO2  2Fe2O3+4SO2
2Fe2O3+4SO2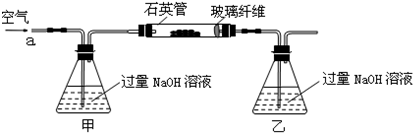
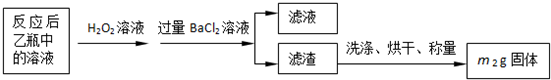
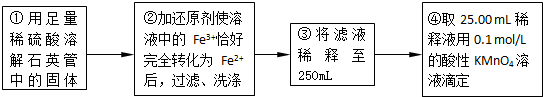
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 24.97 |
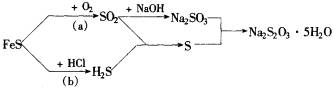
4FeS+7O2=2Fe2O3+4SO2 2H2S+SO2=3S+2H2O
Na2SO3+S=Na2S2O3 用上述途径制备海波(Na2S2O3·5H2O)
(1)计算:原料FeS在反应(a)和(b)中的理论分配比.
(2)现有88 g FeS,设NaOH溶液吸收SO2的吸收率为96%,问最多制备海波质量为多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com