
题目列表(包括答案和解析)
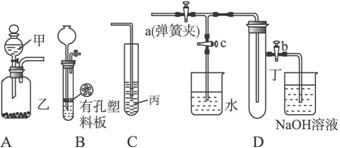
请按要求填空:
(1)利用A或B装置可制取的气体有___________。(写出两种即可)
(2)A、C装置相连后可完成多种实验。
①在甲、乙、丙中分别盛装的试剂为稀盐酸、石灰石、次氯酸钙溶液,则实验开始后在试管中可观察到的现象为________________,该实验可说明相关酸的酸性强弱顺序是______________________________________________________________。
②已知KMnO4在常温下可与浓盐酸反应生成Cl2,请利用该装置设计一个简单的实验验证KMnO4、Cl2、Br2的氧化性强弱。在甲、乙、丙中分别装入___________、___________、___________,反应中若观察到广口瓶A中的现象是______________________,试管C中的现象是______________________,则可证明氧化性的强弱为KMnO4>Cl2>Br2。
(3)当B中盛装浓硝酸和铜片(放在有孔塑料板上)后,可验证铜和浓硝酸反应生成了NO2。
①B、D装置相连后,可进一步验证NO2和水的反应。操作步骤为:先关闭弹簧夹___________,再打开弹簧夹___________,使NO2气体充满试管丁,接着关闭弹簧夹a、b,打开弹簧夹c,___________使烧杯中的水倒流入试管丁。
②当试管中的NO2和水充分反应后,所得溶液中溶质的物质的量浓度的最大值是___________(计算时气体按标准状况对待)。

 A、B、C、X是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去).请回答下列问题:
A、B、C、X是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去).请回答下列问题:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com