
题目列表(包括答案和解析)
(10分,每空2分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
有关离子完全沉淀的pH如下表: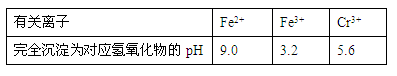
(1)写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式________________________________________________________。
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:_____________(填序号);
A.Na2O2 B.Ca(OH)2 C.Ba(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.12~14 B.10~11 C.6~8 D.3~4
(3)将等体积的4.0×10-3mol·L-1的AgNO3和4.0×10-3mol·L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式(2分),并简要写出能生成Ag2CrO4沉淀原因的计算过程(2分)。
(15分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下还原法,在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
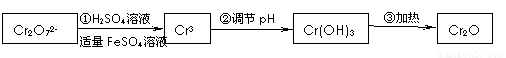
有关离子完全沉淀的pH如下表:
|
有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
|
完全沉淀为对应氢氧化物的pH |
9.0 |
3.2 |
5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 。
(2)还原+6价铬还可选用以下的 试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
在操作②中调节pH应分2次进行,第1次应先调节溶液的pH范围约在 (填序号)最佳,第2次应调节溶液的pH范围约在 (填序号)最佳
A.3~4 B.6~8 C.10~11 D.12~14
用于调节溶液的最佳试剂为: (填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
(6分)已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为 。
(2)若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的电子式为 。
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明) 。
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为 。
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为 。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为 。
(15分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下还原法,在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 。
(2)还原+6价铬还可选用以下的 试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
在操作②中调节pH应分2次进行,第1次应先调节溶液的pH范围约在 (填序号)最佳,第2次应调节溶液的pH范围约在 (填序号)最佳
A.3~4 B.6~8 C.10~11 D.12~14
用于调节溶液的最佳试剂为: (填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
(6分)已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:

(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为 。
(2)若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的电子式为 。
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明) 。
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为 。
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为 。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com