
题目列表(包括答案和解析)
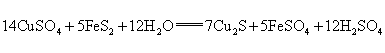
对上述事实的下列分析,正确的是( )
A.![]() 既是氧化剂,又是还原剂
既是氧化剂,又是还原剂
B.![]() 是还原产物,
是还原产物,![]() 是氧化产物
是氧化产物
C.在上述反应中,每生成1mo1![]() 时,共得到2 mol电子
时,共得到2 mol电子
D.![]() 是氧化剂,
是氧化剂,![]() 是还原剂
是还原剂
从矿物学家资料查得:当胆矾溶液渗入地下遇硫铁矿(FeS2)时,可以生成辉铜矿(Cu2S),同时,还生成FeSO4和H2SO4,化学方程式如下:
14CuSO4+5FeS2+12H2O→7Cu2S+5FeSO4+12H2SO4
对上述事实的下列分析,正确的是
[ ]
A.FeS2既是氧化剂,又是还原剂
B.Cu2S是还原产物,FeSO4是氧化产物
C.在上述反应中,每生成1mol Cu2S时,共得到2mol电子
D.CuSO4是氧化剂,FeS2是还原剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com