
题目列表(包括答案和解析)
| ||
| ||
| b-d |
| 16 |
| b-d |
| 16 |
| 16(d-a) |
| b-d |
| 16(d-a) |
| b-d |
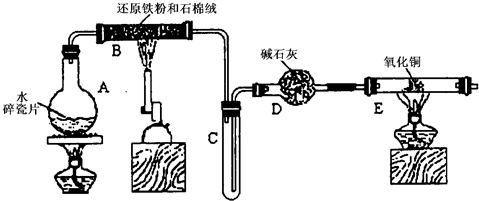
(20分)某课外小组利用H2还原CuO粉末测定铜元素的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸,C中试剂是稀氢氧化钠溶液。
请回答下列问题。
(1)仪器中装入的试剂:B 、D 。
(2)装置C的作用是 。
(3)连接好装置后应首先 。
(4)“①加热反应管E”和“②从A瓶逐滴滴加液体”这两步操作应该先进行的是 (填序号)。在这两步之间还应进行的操作是 。
(5)反应过程中G管逸出的气体是 ,其处理方法是 。
(6)从实验中测得了下列数据:
①空E管的质量a ; ②E管和CuO的总质量b;
③反应后E管和Cu粉的总质量c(冷却到室温称量);
④反应前F管及内盛物的总质量d ;⑤反应后F管及内盛物的总质量e。
由以上数据可以列出计算Cu的相对原子质量的两个不同计算式(除Cu外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(Cu)= ;计算式2:Ar(Cu)= 。
(20分)某课外小组利用H2还原CuO粉末测定铜元素的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸,C中试剂是稀氢氧化钠溶液。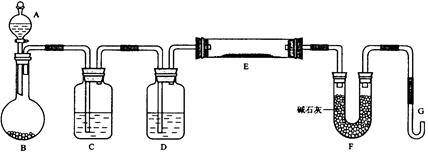
请回答下列问题。
(1)仪器中装入的试剂:B 、D 。
(2)装置C的作用是 。
(3)连接好装置后应首先 。
(4)“①加热反应管E”和“②从A瓶逐滴滴加液体”这两步操作应该先进行的是 (填序号)。在这两步之间还应进行的操作是 。
(5)反应过程中G管逸出的气体是 ,其处理方法是 。
(6)从实验中测得了下列数据:
①空E管的质量a;②E管和CuO的总质量b;
③反应后E管和Cu粉的总质量c(冷却到室温称量);
④反应前F管及内盛物的总质量d;⑤反应后F管及内盛物的总质量e。
由以上数据可以列出计算Cu的相对原子质量的两个不同计算式(除Cu外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(Cu)= ;计算式2:Ar(Cu )= 。
(20分)某课外小组利用H2还原CuO粉末测定铜元素的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸,C中试剂是稀氢氧化钠溶液。
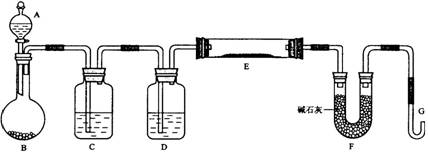
请回答下列问题。
(1)仪器中装入的试剂:B 、D 。
(2)装置C的作用是 。
(3)连接好装置后应首先 。
(4)“①加热反应管E”和“②从A瓶逐滴滴加液体”这两步操作应该先进行的是 (填序号)。在这两步之间还应进行的操作是 。
(5)反应过程中G管逸出的气体是 ,其处理方法是 。
(6)从实验中测得了下列数据:
①空E管的质量a ; ②E管和CuO的总质量b ;
③反应后E管和Cu粉的总质量c(冷却到室温称量);
④反应前F管及内盛物的总质量d ;⑤反应后F管及内盛物的总质量e。
由以上数据可以列出计算Cu的相对原子质量的两个不同计算式(除Cu外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(Cu)= ;计算式2:Ar(Cu )= 。
某课外小组利用H2还原CuO粉末测定铜元素的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸,C中试剂是稀氢氧化钠溶液。
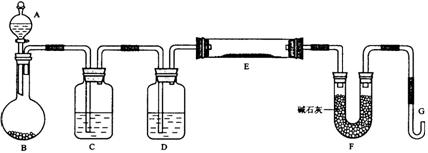
请回答下列问题。
(1)仪器中装入的试剂:B 、D 。
(2)装置C的作用是 。
(3)连接好装置后应首先 。
(4)“①加热反应管E”和“②从A瓶逐滴滴加液体”这两步操作应该先进行的是 (填序号)。在这两步之间还应进行的操作是 。
(5)反应过程中G管逸出的气体是 ,其处理方法是 。
(6)从实验中测得了下列数据:
①空E管的质量a ; ②E管和CuO的总质量b ;
③反应后E管和Cu粉的总质量c(冷却到室温称量);
④反应前F管及内盛物的总质量d ;⑤反应后F管及内盛物的总质量e。
由以上数据可以列出计算Cu的相对原子质量的两个不同计算式(除Cu外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(Cu)= ;计算式2:Ar(Cu )= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com