
题目列表(包括答案和解析)
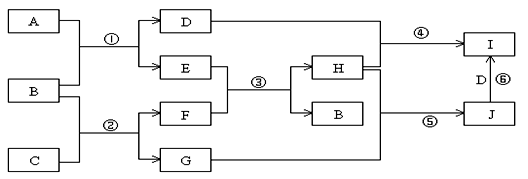
(8分)A、B、C、D、E、G、H、I、J是中学化学常见的9种化合物,E、F、H常温下呈气态,其中F是人类生存不能离开的气态单质,B是常温下呈液态的含两种元素的化合物,化合物C中既含离子键又含非极性共价键,I为白色沉淀,反应③常用于焊接和切割金属,其转化关系如下图,据此回答下列问题:
(1)写出反应①的化学方程式: ;
(2)写出反应②的化学方程式: ;
(3)列出两种E能发生的反应类型: (至少写两种)
(4)写出少量的H和D溶液反应的离子方程式:
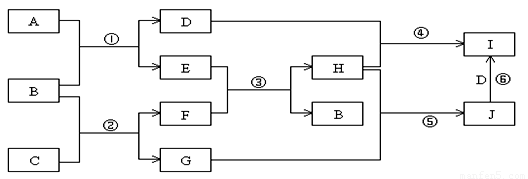
(8分)A、B、C、D、E、G、H、I、J是中学化学常见的9种化合物,E、F、H常温下呈气态,其中F是人类生存不能离开的气态单质,B是常温下呈液态的含两种元素的化合物,化合物C中既含离子键又含非极性共价键,I为白色沉淀,反应③常用于焊接和切割金属,其转化关系如下图,据此回答下列问题: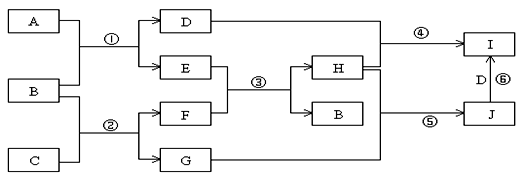
(1)写出反应①的化学方程式: ;
(2)写出反应②的化学方程式: ;
(3)列出两种E能发生的反应类型: (至少写两种)
(4)写出少量的H和D溶液反应的离子方程式:
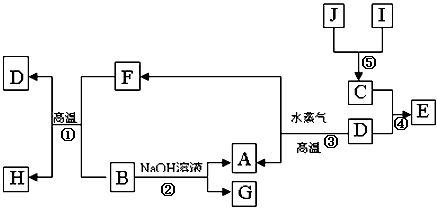
(8分)A、B、C、D、E、G、H、I、J是中学化学常见的9种化合物,E、F、H常温下呈气态,其中F是人类生存不能离开的气态单质,B是常温下呈液态的含两种元素的化合物,化合物C中既含离子键又含非极性共价键,I为白色沉淀,反应③常用于焊接和切割金属,其转化关系如下图,据此回答下列问题:
(1)写出反应①的化学方程式: ;
(2)写出反应②的化学方程式: ;
(3)列出两种E能发生的反应类型: (至少写两种)
(4)写出少量的H和D溶液反应的离子方程式:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com