
题目列表(包括答案和解析)
50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。
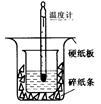
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器
是 。装置中还存在的2个错误是①__
② 这种错误会造成最高温度读数________(填“增大”、“减小”或“无影响”);测得的中和热将____________(填“偏大”、“偏小”或“无影响”)。
(2)在实验过程中,该同学需要测定并记录的实验数据有 (填序号)。
A.盐酸的浓度
B.盐酸的温度
C.氢氧化钠溶液的浓度
D.氢氧化钠溶液的温度
E.水的比热容
F.反应后混合溶液的终止温度
(3)实验中改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述正确的实验操作相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 ;(填“偏大”“偏小”或“无影响”)。
如下图所示的装置中,A是氯气发生装置,C、D 为气体净化装置(C中装有饱和食盐水;D 中装有浓硫酸),E 是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液。
试回答:
(1)实验室制氯气的化学方程式:_______________________________;
(2)C装置的作用是________________;D 装置的作用是__________________;
E中发生化学反应的方程式为:_____________________________。
(3)烧杯G 中装有氢氧化钠溶液的作用是___________________;发生反应的化学方程式为:_______________________________________。
如下图所示的装置中,A是氯气发生装置,C、D 为气体净化装置(C中装有饱和食盐水;D 中装有浓硫酸),E 是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液。
试回答:
(1)实验室制氯气的化学方程式:_______________________________;
(2)C装置的作用是________________;D 装置的作用是__________________;
E中发生化学反应的方程式为:_____________________________。
(3)烧杯G 中装有氢氧化钠溶液的作用是___________________;发生反应的化学方程式为:_______________________________________。
100ml0.50mol·L-1盐酸与100mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题: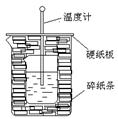
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)烧杯间填满碎纸条的作用是 。
(3)实验中若改用110mL0.50mol·L-1盐酸跟100mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 ;(填“偏大”“偏小”或“无影响”)。
(5)在量热计中将22.3℃、100ml 1.0mol/L的盐酸与等体积等温度的1.00mol/L的氢氧化钠溶液混合,温度最高升高到29.00℃。已知量热计的热容是46.1J/K,此条件下的NaCl溶液的比热容为4.03J/(g.K),溶液的密度为1.02g/ml,试计算生成每摩NaCl的
反应热(直接写答案) KJ/mol。
(16分)(1)在中和滴定操作过程中,有以下各项因操作不当引起的实验误差,用“偏高”、“偏低”或“无影响”填空:
①滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果 ;
②锥形瓶用蒸馏水洗净后,又用待测溶液润洗,使滴定结果 ;
③滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡,使滴定结果 ;
④滴定前平视,滴定终了俯视,使滴定结果 ;
⑤用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度 ;
⑥洗涤锥形瓶时,误把稀食盐水当做蒸馏水,然后用锥形瓶装待测的盐酸,用NaOH标准溶液滴定时,对测得的结果 。
(2)已知H+(aq)+OH-(aq) = H2O(l) ΔH= -57.3kJ·mol-1。用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
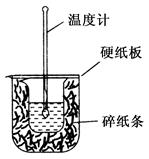
①从实验装置上看,图中尚缺少一种玻璃仪器是 。
②大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”或“无影响”)。
③若通过实验测定中和热的ΔH,其结果常常大于-57.3kJ·mol-1,其原因可能是:
。
(3)分别设计化学实验,用最佳方法证明明矾溶于水时发生的下列变化(供选用的药品和仪器:明矾溶液、石蕊试液、酚酞试液、pH试纸、酒精灯):
①证明明矾发生了水解反应 。
②证明其水解反应是一个吸热反应 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com