(2011?山西模拟)甲醛是重要的有机合成原料,大量用于生产树脂、合成纤维、药物、涂料等,也是世界卫生组织(WHO)确认的致癌物和致畸物质之一.据中国室内环境监测工作委员会调查统计,中国新装家庭甲醛超标60%以上.我国规定室内空气中甲醛含量不得超过0.08mg/m
3.
(1)下列说法或做法不合理的是
a
a
.(填字母)
a.用甲醛溶液浸泡水产品以长时间保持水产品的“新鲜”
b.刚装修的新房入住前房间内保持一定温度并注意通风
c.合成“吊白块”的反应NaHSO
3+HCHO→NaO-CH
2-SO
3H是加成反应
d.福尔马林可用于制作动物标本(或保存尸体)
(2)某研究性学习小组拟用甲醛法测定常见铵态氮肥的含氮量
〔资料:4NH
4++6HCHO=(CH
2)
6N
4H
++3H
++6H
2O,所生成的H
+和(CH
2)
6N
4H
+可用NaOH标准溶液滴定,采用酚酞作指示剂〕.
用甲醛法测定含氮量,不适合的铵盐是
a
a
.(填字母)
a.NH
4HCO
3 b.(NH
4)
2SO
4 c.NH
4Cl
(3)工业制甲醛的两种方法如下(数据均为298.15K下测定):
反应I:
CH
3OH(g)→HCHO(g)+H
2(g)△H
1=+92.09kJ/mol,K
1=3.92×10
-11反应II:
CH
3OH(g)+
O
2(g)→HCHO(g)+H
2O(g)△H
2=-149.73kJ/mol,K
2=4.35×10
29①绿色化学提倡化工生产应提高原子利用率.反应
I
I
(填“I”或“II”)制甲醛原子利用率更高.从反应的焓变和平衡常数K值看,反应
II
II
(填“I”或“II”)制甲醛更加有利.
②反应Ⅱ自发进行的条件是
C
C
(填字母).
a.高温b.低温c.任何条件
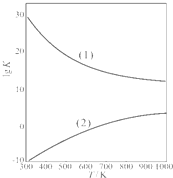
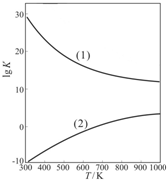
③右上图是甲醇制甲醛有关反应的lgK(平衡常数的对数值随温度T的变化.图中曲线(1)表示的是反应
II
II
(填“I”或“II”).
(4)某研究性学习小组测定居室中甲醛的含量的原理如下:
4MnO
4-+5HCHO+12H
+=4Mn
2++5CO
2↑+11H
2O
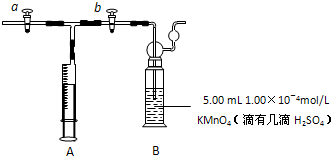
打开a,关闭b,用注射器抽取室内空气;关闭a,打开b,再推动注射器,将气体缓缓推入酸性KMnO
4溶液中,使其充分反应.当B装置中
酸性KMnO4溶液颜色突然褪去
酸性KMnO4溶液颜色突然褪去
时停止推气.若总共取样为50L空气,则该居室内空气中甲醛的浓度
0.375
0.375
mg/m
3.


 或
或 
 或
或 






 (2011?山西模拟)甲醛是重要的有机合成原料,大量用于生产树脂、合成纤维、药物、涂料等,也是世界卫生组织(WHO)确认的致癌物和致畸物质之一.据中国室内环境监测工作委员会调查统计,中国新装家庭甲醛超标60%以上.我国规定室内空气中甲醛含量不得超过0.08mg/m3.
(2011?山西模拟)甲醛是重要的有机合成原料,大量用于生产树脂、合成纤维、药物、涂料等,也是世界卫生组织(WHO)确认的致癌物和致畸物质之一.据中国室内环境监测工作委员会调查统计,中国新装家庭甲醛超标60%以上.我国规定室内空气中甲醛含量不得超过0.08mg/m3.