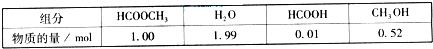(2010?聊城模拟)联合国气候变化大会于2009年12月7~18目在哥本哈根召开.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
(1)有效“减碳”的手段之一是节能.下列制氢方法最节能的是
C
C
(填字母序号).
A.电解水制氢:2H
2O
2H
2↑+O
2↑
B.高温使水分解制氢:2H
2O
2H
2↑+O
2↑
C.太阳光催化分解水制氢:2H
2O
2H
2↑+O
2↑
D.天然气制氢:CH
4+H
2O
CO+3H
2 (2)用CO
2和氢气合成CH
3OCH
3(甲醚)是解决能源危机的研究方向之一.
己知:CO(g)+2H
2(g)?CH
3OH(g)△H=-90.7KJ?mol
-1 ①
2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)△H=-23.5KJ ②
CO
2(g)+H
2(g)△H=-41.2KJ?mol
-1 ③
则反应2CO
2(g)+6H
2(g)→2CH
3OH(g)+2H
2O(g)的△H=
-122.5KJ?mol-1
-122.5KJ?mol-1
.
(3)CO
2可转化成有机物实现碳循环:CO
2→CH
3OH→HCOOH,用离子方程式表示HCOONa溶液呈碱性的原因
HCOO-+H2O=HCOOH+OH-
HCOO-+H2O=HCOOH+OH-
,写出该反应的平衡常数(K
h)表达式:K
h=
,升高温度,K
h增大
增大
(选填“增大”、“减小”或“不变”).
(4)常温下,将0.2mol?L
-1HCOOH和0.1mol?L
-1NaOH溶液等体积混合,所得溶液的pH<7,说明HC00H的电离程度
大于
大于
HCOONa的水解程度(填“大于”或“小于”).该混合溶液中离子浓度由大到小的顺序是
C(HCOO-)>C(Na+)>C(H+)>C(OH-)
C(HCOO-)>C(Na+)>C(H+)>C(OH-)
.

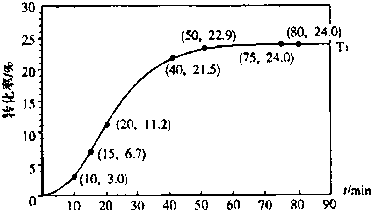
 (2009?广东)甲酸甲酯水解反应方程式为:
(2009?广东)甲酸甲酯水解反应方程式为: HCOOH(l)+CH3OH(l)△H>0
HCOOH(l)+CH3OH(l)△H>0