
题目列表(包括答案和解析)
氮有多种氧化物,其中亚硝酐N2O3很不稳定,在液体或蒸气中大部分离解成NO和NO2,因而在NO转化成NO2的过程中几乎没有N2O3生成。亚硝酸也不稳定,在微热甚至常温下也会分解。亚硝酸钠是一种致癌物质,它在中性或碱性条件下是稳定的,酸化后能氧化碘化钾生成碘和NO气体。
(1)写出亚硝酸分解的化学方程式 ;
(2)写出酸性溶液中亚硝酸钠和碘化钾反应制取一氧化氮的离子方程式
(3)在隔绝空气的条件下按以下操作:先向亚硝酸钠中加入稀盐酸,片刻后再加入碘化钾溶液,这样制得的气体的平均分子量 30(填“大于、小于或等于”)。
含有硫的化合物在工业生产中应用广泛,回答下列问题:
(1)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2。
①测得某黄铜矿(CuFeS2)中含硫20%(质量分数),求该矿石含铜的质量分数。
②现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:称取
研细的黄铜矿样品1.150g,在空气中进行煅烧,生成Cu、Fe3O4和SO2气体,用100 mL滴有淀粉的
蒸馏水全部吸收SO2,然后取10mL吸收液,用0.05mol/L标准碘溶液进行滴定,用去标准碘溶液的体
积为20.00mL。求该黄铜矿的纯度。
(2)将FeS和Fe2O3的混和物56.6 g,用足量稀H2SO4溶解后可得3.2 g硫,原混和物中FeS的质量。
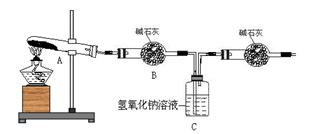
(3)一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧
化钠溶液吸收。利用下图装置加热无水硫酸铜粉末直至完全分解。若无水硫酸铜粉末质量为10.0 g,
完全分解后,各装置的质量变化关系如下表所示。
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0 g | 75.0 g | 140.0 g |
| 反应后 | 37.0 g | 79.0 g | 140.5 g |
 Na2S + 4CO↑ ②Na2SO4 + 4CO
Na2S + 4CO↑ ②Na2SO4 + 4CO Na2S + 4CO2
Na2S + 4CO2 | 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0 g | 75.0 g | 140.0 g |
| 反应后 | 37.0 g | 79.0 g | 140.5 g |

 Na2S + 4CO↑ ②Na2SO4 + 4CO
Na2S + 4CO↑ ②Na2SO4 + 4CO Na2S + 4CO2
Na2S + 4CO2 
| 实验编号 | ①中的物质 | ②中的物质 |
| 1 | 淀粉碘化钾溶液 | 浓硝酸 |
| 2 | 酚酞溶液 | 浓硫酸 |
| 3 | 氯化铝溶液 | 浓氨水 |
| 4 | 湿润的红纸 | 饱和氯水 |

下表是某超市出售的加碘食盐的有关说明:
| 配 料 表 | 精制盐、碘酸钾 |
| 含 碘 量 | 45±5mg/kg |
| 储 藏 方 法 | 通风、防潮 |
| 食 用 方 法 | 根据烹调所需适量加入 |
某研究性学习小组欲通过实验检验该碘盐中是否含碘:
(1)首先取该食盐样品配制室温下的饱和溶液:向200 mL蒸馏水中加入75.0g 该食盐样品,加热并搅拌,直到完全溶解。冷却至室温。(已知室温条件下氯化钠溶解度为36 g)
在加热过程中需要用到的仪器有铁架台、酒精灯、铁圈、____________、烧杯和玻璃棒。冷却至室温过程中若出现____________________(填现象),则证明其为饱和溶液。
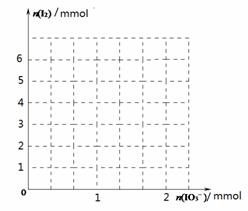 (2)甲同学先向该饱和食盐溶液中加入1mol/L的KI溶液和几滴淀粉溶液,然后加入0.1mol/L稀硫酸,振荡,溶液变为蓝色。该实验发生的化学反应中氧化剂与还原剂的物质的量之比为_______________。请在右图中画出参加反应的IO3—的物质的量和析出的I2单质的物质的量的关系曲线。
(2)甲同学先向该饱和食盐溶液中加入1mol/L的KI溶液和几滴淀粉溶液,然后加入0.1mol/L稀硫酸,振荡,溶液变为蓝色。该实验发生的化学反应中氧化剂与还原剂的物质的量之比为_______________。请在右图中画出参加反应的IO3—的物质的量和析出的I2单质的物质的量的关系曲线。
(3)乙同学认为甲同学的实验方案不严谨,他提出如下假设:空气中的氧气可能参与反应,使溶液变蓝。反应的离子方程式为:_____________________________________。请你设计实验方案验证乙同学的假设是否正确:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com