
题目列表(包括答案和解析)
(14分)(1)已知:
Fe(s)+1/2O2(g)=FeO(s) ![]()
2Al(s)+3/2O2(g)= Al2O3(s) 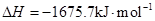
Al和FeO发生铝热反应的热化学方程式是________________________________________。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
①据图判断该反应是_____(填“吸”或“放”) 热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率__ _ _ (填“增大”、“减小”或“不变”)
②其中B历程表明此反应采用的条件为______ (选填下列序号字母)
A、升高温度 B、增大反应物的浓度
C、降低温度 D、使用了催化剂
(3) 1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+ 4H2(g) Na2S(s) + 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性_______ _____
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol·L-1NaOH溶液中水电离出的c(H+)比较
(填<、>、=)。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为 。(填序号)
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(本题共14分)按要求完成下列各题14分
(1)下列各组物质 ① O2和O3 ②12C和14C

互为同位素的是 , 互为同素异形体的是__________,互为同分异构体的是_____________
(2)如下图所示,把试管放入盛有25℃的饱和石灰水溶液的烧杯中,试管中开始放入几小片镁片,再用滴管滴入5 mL盐酸于试管中。回答下列问题:

①实验中观察到的现象是_____________________。
②产生上述现象的原因是___________________。
③写出有关反应的离子方程式__________________。
④由实验推知,所得MgCl2溶液和H2的总能量___________(填“大于”“小于”“等于”)原来镁片和盐酸的总能量。
(14分)(1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g) 4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,则:υ(NO2)为 、5min时,N2O5占混合气体体积分数是 。
阅读资料,回答(2)、(3)小题
锌铜原电池用画图的方式(如图)表示很不方便,常常采用电池图式表达式,如Zn|ZnSO4(1mol/L)||CuSO4(1mol/L)|Cu 上式中,发生氧化反应的负极写在左边,发生还原反应的正极写在右边。用实垂线“|”表示电极与溶液之间的界面,用双实垂线“||”表示盐桥。
(2)上述资料列举的电池中,锌片上发生的电极反应式是 ,
(3)现有一电池,其图式表达式为Cu|CuSO4(1mol/L)||Fe2(SO4)3(0.5mol/L)|C。该电池中,正极的电极反应式是 ,负极的电极反应式是 。
(4)写出支链只有一个乙基且式量最小的烷烃的结构简式
(14分)(1)已知:
Fe(s)+1/2O2(g)=FeO(s) 
2Al(s)+3/2O2(g)= Al2O3(s) 
Al和FeO发生铝热反应的热化学方程式是________________________________________。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。

①据图判断该反应是_____(填“吸”或“放”) 热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率__ _ _ (填“增大”、“减小”或“不变”)
②其中B历程表明此反应采用的条件为______ (选填下列序号字母)
A、升高温度 B、增大反应物的浓度
C、降低温度 D、使用了催化剂
(3) 1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)
+ 4H2(g)  Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性_______ _____
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol·L-1NaOH溶液中水电离出的c(H+)比较
(填<、>、=)。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为 。(填序号)
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(14分)(1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)  4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,则:υ(NO2)为
、5min时,N2O5占混合气体体积分数是 。
4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,则:υ(NO2)为
、5min时,N2O5占混合气体体积分数是 。
阅读资料,回答(2)、(3)小题
锌铜原电池用画图的方式(如图)表示很不方便,常常采用电池图式表达式,如Zn|ZnSO4(1mol/L)||CuSO4(1mol/L)|Cu 上式中,发生氧化反应的负极写在左边,发生还原反应的正极写在右边。用实垂线“|”表示电极与溶液之间的界面,用双实垂线“||”表示盐桥。

(2)上述资料列举的电池中,锌片上发生的电极反应式是 ,
(3)现有一电池,其图式表达式为Cu|CuSO4(1mol/L)||Fe2(SO4)3(0.5mol/L)|C。该电池中,正极的电极反应式是 ,负极的电极反应式是 。
(4)写出支链只有一个乙基且式量最小的烷烃的结构简式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com