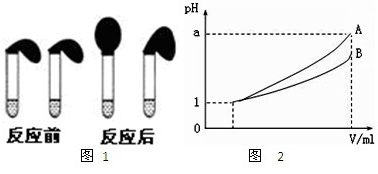
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动.实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两只试管中,同时加入0.1mol?L
-1的 HA、HCl溶液各10mL,按图1装好,观察现象
乙:①用pH计测定物质的量浓度均为0.1mol?L
-1HA和HCl溶液的pH;
②再取0.1mol?L
-1的HA和HCl溶液各2滴(1滴约为1/20mL)分别稀释至100mL,再用pH计测其pH变化
(1)乙方案中说明HA是弱电解质的理由是:测得0.1mol?L
-1的HA溶液的pH
>
>
1(填“>”、“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是:
B
B
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后,试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第
②
②
步,能证明改变条件弱电解质平衡发生移动.甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:①使HA的电离程度和C(H
-)都减小,C(A
-)增大,可在0.1mol.L
-2的HA溶液中,选择加入
A
A
试剂(选填“A”“B”“C”“D”.下同);②使HA的电离程度减小,C(H
-)和C(A
-)都增大,可在0.1mol.L
-2的HA溶液中,选择加入
D
D
试剂.
A.NaA固体(可完全溶于水) B.1mol.L
-2NaOH溶液 C.1mol.L
-2H
2SO
2 D.2mol.L
-2-HA
(3)pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图2所示,则下列说法不正确的有
A
A
A.两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸.

