
题目列表(包括答案和解析)
 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.- 4 |
- 4 |
2- 4 |
2- 8 |
2- 8 |
+ 4 |
+ 4 |
“神七”登天谱写了我国航天事业的新篇章。火箭升空需要高能的燃料,通常用肼(N2H4)作为燃料,N2O4做氧化剂。
(1)已知:N2(g) + 2O2(g) =2NO2(g) △H=+67.7 kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H=-534.0 kJ·mol-1
2NO2(g) N2O4(g)
△H=-52.7 kJ·mol-1
N2O4(g)
△H=-52.7 kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: 。
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为: 。
(3)一定条件下,在2L密闭容器中起始投入2 mol NH3和4 mol O2发生反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
ΔH<0
4NO(g)+6H2O(g)
ΔH<0
测得平衡时数据如下:
|
平衡时物质的量(mol) |
n(NO) |
n(H2O) |
|
温度T1 |
1.6 |
2.4 |
|
温度T2 |
1.2 |
1.8 |
①在温度T1下,若经过10min反应达到平衡,则10min内反应的平均速率
v(NH3)= 。
②温度T1和T2的大小关系是T1 T2(填“>”、 “<”或“=”)。
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为: =O2↑+2H2O,则阴极反应为 。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由 。
=O2↑+2H2O,则阴极反应为 。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由 。
(5)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液。

如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为 mol。
(14分)某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
甲 + 乙 丙 + 丁 + 水。
丙 + 丁 + 水。
(1)若丙为NO2。
①甲与乙反应的化学方程式为 。
②火箭常用NO2的二聚体N2O4作氧化剂,肼(N2H4)作燃料,已知:
N2(g)+2O2(g)=2NO2(g) △H =-67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-534.0kJ·mol-1
2NO2(g) N2O4(g)
△H =-52.7kJ·mol-1
N2O4(g)
△H =-52.7kJ·mol-1
试写出气态肼(N2H4)在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
___________________________________________________。
③肼又称联氨,广泛用于火箭推进剂、有机合成及燃料电池。肼燃料电池原理如右图所示,右边电极为 (填“正极”、“负极”),左边电极上发生的电极反应式为 。

(2)若丙为SO2。
①把乙滴入硫酸铜晶体中,观察到的现象是 。
②SO2气体有毒,多余的SO2气体常用足量的NaOH溶液吸收,写出吸收液中离子浓度由大到小的顺序: 。
③在氧化还原反应的过程中,氧化反应和还原反应同时发生,有关反应:
SO2-2e-+2H2O = SO42-+4H+反应的说法错误的是 。
A.该反应为氧化反应
B.上述反应中若转移电子物质的量为0.05mol,则生成溶液的PH值为1
C.Fe2(SO4)3、品红两种溶液都能使上述反应进行
D.通入Cl2会降低SO2的漂白作用
(14分)
“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g) △H = +67.7 kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H = -534.0 kJ·mol-1
NO2(g)
 1/2N2O4(g)
△H = -26.35 kJ·mol-1
1/2N2O4(g)
△H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
_______________________________________________________________________。
(2)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
燃料电池放电时的负极反应为:___________________________________。
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为______________mol。

(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH——4e— = O2↑+2H2O,则阴极反应为:____________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行?_______,理由是:___________________________________。
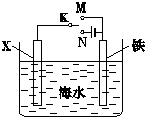 (1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于
(1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于| 实验方法 | 实验现象及结论 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com