
题目列表(包括答案和解析)
以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高.其主要流程如下:
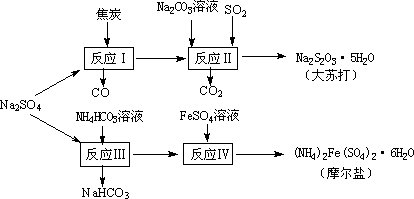
试回答下列问题:
(1)已知反应Ⅰ中发生的主要反应为:Na2SO4(s)+4C(s)=Na2S(s)+4CO(g)ΔH=+569.99 kJ/mol,欲使该反应发生并维持该反应进行的条件是________.
(a)常温
(b)常温,并通入少量CO2
(c)高温,并通入适量的O2
(2)配平反应Ⅱ的化学方程式:□Na2S+□Na2CO3+□SO2=□Na2S2O3+□CO2________
(3)反应Ⅲ温度需控制在35~40℃的较低温度,其主要原因是________.
(4)在摩尔盐溶液中加入一种物质的溶液可使NH4+、Fe2+、SO![]() 都大量减少,该物质是________.
都大量减少,该物质是________.
(5)反应Ⅳ中两种盐溶液混合时,需加入适量的H2SO4,将溶液pH调到1,用离子方程式说明原因:________
I.纯碱、烧碱等是重要的化工原料。
(1)利用上图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是___________________,
若其他操作不变,将A与C连接,可观察到的现象是__________________________。
(2)向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体的组成可能是:
A.NaOH和Na2CO3;B. ;C. ;D. 。
(3)设计实验确定(2)中白色固体中存在A项中的阴离子:
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | | |
| ② | | |

I.纯碱、烧碱等是重要的化工原料。

(1)利用上图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是___________________,
若其他操作不变,将A与C连接,可观察到的现象是__________________________。
(2)向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体的组成可能是:
A.NaOH和Na2CO3;B. ;C. ;D. 。
(3)设计实验确定(2)中白色固体中存在A项中的阴离子:
实验操作 | 实验现象 | 结论 |
①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 |
|
|
②
|
|
|
II.化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙,氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生。
牙膏样品中碳酸钙的定量测定:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应
后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(1)实验过程中需持续缓缓通入空气。其作用除了可搅拌B,C中的反应物外,还有: 。
(2)C中反应生成BaCO3的离子方程式是 。
(3)下列各项措施中,不能提高测定准确度的是( )
A.在加入盐酸之前,应排净装置内的CO2气体
B.滴加盐酸不宜过快
C.在A~B之间增添盛有浓硫酸的洗气装置
D.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g.则样品中碳酸钙的质量分数为________。
(5)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是 _________________________________。
(6)装置中U形管D中的碱石灰的作用是_____________________________。

| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | | |
| ② | | |

四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:![]()
![]()
![]() w_w w. k#s5_u.c o*m
w_w w. k#s5_u.c o*m

请回答下列问题:![]()
![]()
![]() w_w w. k#s5_u.c o*m
w_w w. k#s5_u.c o*m
(1) 硫酸与二氧化钛反应的化学方程式是____________________________________。
(2) 向滤液I中加入铁粉,发生反应的离子方程式为:_________________________、_______________________________________。
(3) 在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_______________________________________________。
过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、___________、______________、_______________________(填化学式),减少废物排放。
(4)A可用于生产红色颜料(Fe2O3),其方法是:将556a kgA(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com