
题目列表(包括答案和解析)
某化学课外活动小组在实验室做了如下一系列实验:
(1)该小组设计了如图所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能
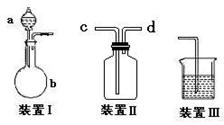 性。
性。
① 甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加
入 或 ,装置Ⅱ从 管口进气即可作为O2的收集装置。
 ② 乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法:
② 乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法:
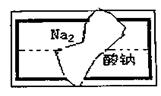
(2)小组在整理实验室的化学试剂时,发现一盛有
无色溶液的试剂瓶。标签破损(如图),请你根
据已掌握的知识,对该试剂可能是什么物质的溶
液作出二种猜想,并设计实验验证,写出任一种
的实验操作、现象和结论。
| 猜想物质的化学式 | 检验所需要的试剂 | 操作、现象和结论 | |
| ① | |||
| ② |
|
(3)该小组从ZnSO4、FeCl3的混合溶液中制取ZnSO4?7H2O过程如下:
a.在混合液中加入6 mol?L―1NaOH溶液,至pH=8为止。
b.过滤后得到沉淀,用蒸馏水多次洗涤沉淀。
c.向洗涤后的沉淀中加入2 mol?L―1的硫酸,保持溶液的pH在4~6,加热煮沸,
趁热过滤,滤液即为ZnSO4溶液
d.滤液中注入2 mol?L―1的硫酸,使其pH保持为2……
已知部分阳离子以氢氧化物的形式开始沉淀至完全沉淀时溶液的pH见下表,回答下列
问题:
| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5~3.2 | 6.4~8.0 |
① 步骤a中用pH试纸控制溶液pH=8,使用pH试纸的操作是 ;步骤b中如何
检验沉淀已经洗涤干净? 。
② 要制得ZnSO4?7H2O的步骤d还缺少的操作是 ,所用的主要硅酸盐
仪器是 。
原电池、电解(电镀)池是化学反应利用方面的典型事例,体现出能量之间的转换,受到越来越多的关注。按要求回答下列各个问题。
(1)南昌大学最近研发出一种新型纳米锂电池,已跻身国内领先地位。锂离子电池的正极材料是锂过渡金属氧化物(例如LiCoO2)混以一定量的导电添加物(例如C)构成的混合导体,负极材料是可插入锂的碳负极。两极的电极反应式:
负极:![]() 正极:
正极:![]() 。
。
充、放电时电池中的变化简单表示为:![]() (a、b、c、d表示充放电过程)。其中表示充电时阴极发生变化的过程是 (填a、b、c、d),判断理由是 。
(a、b、c、d表示充放电过程)。其中表示充电时阴极发生变化的过程是 (填a、b、c、d),判断理由是 。
(2)在正负极之间是固体电解质。固体电解质又称离子导体,在一定温度范围内具有很强的导电性。固体电解质虽然是固体,但却像电解质溶液一样为离子的导电载体。下列物质能作为固体电解质的是 (填编号)。
①特种钢;②硝酸钾晶体;③银;④高纯度硅。
(3)实验室中用该类电池在铁棒上镀铜,当有lmol电子发生转移时,则正极产生物质的质量为 g。
(4)为了使产品更耐腐蚀和美观,通常采用电镀的方式,但随之而来的是污染问题。某电镀厂处理有氰电镀的废水时,用Ti02作催化剂,用NaCl0将CN-离子氧化成CNO-,CNO-在酸性条件下继续被NaClO氧化成N2和C02;用如图装置实验,通过测定二氧化碳的量确定CN-的含量。将浓缩后含CN-离子200mL的污水与过量NaClO溶液的混合液,倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。
①甲中反应的离子方程式为_____________

②乙中除生成N2和C02外,还有HCl及副产物Cl2等。在上述装置中HCl和C12是如何被除掉的?______。
③实验后得到0.4吧沉淀,则浓缩后的污水中CN-的含量为 g/L。
下列物质中可作为实验室制氧气的原料的是
①Na2O ②Na2O2 ③KOH ④MnO2 ⑤KClO3 ⑥KMnO4
[ ]
 北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.请回答下列问题:
北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.请回答下列问题:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com