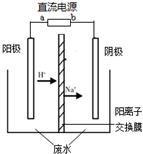
(2012?海淀区二模)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、电解阳极发生反应,转化为乙醇和乙酸,总反应为:2CH
3CHO+H
2O═CH
3CH
2OH+CH
3COOH实验室中,以一定浓度的乙醛-Na
2SO
4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示.
(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入
CH4
CH4
(填化学式)气体.
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体.电极反应如下:
阳极:①4OH
--4e
-═O
2↑+2H
2O
②
CH3CHO-2e-+H2O═CH3COOH+2H+
CH3CHO-2e-+H2O═CH3COOH+2H+
阴极:①
4H++4e-═2H2↑或4H2O+4e-═2H2↑+4OH-
4H++4e-═2H2↑或4H2O+4e-═2H2↑+4OH-
②CH
3CHO+2e
-+2H
2O═CH
3CH
2OH+2OH
-(3)电解过程中,阴极区Na
2SO
4的物质的量
不变
不变
(填“增大”、“减小”或“不变”).
(4)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na
2SO
4与CH
3COOH的物质的量相同.下列关于阳极区溶液中各微粒浓度关系的说法正确的是
abd
abd
(填字母序号).
a.c(Na
+)不一定是c(SO
42-)的2倍
b.c(Na
+)=2c(CH
3COOH)+2c(CH
3COO
-)
c.c(Na
+)+c(H
+)=c(SO
42-)+c(CH
3COO
-)+c(OH
-)
d.c(Na
+)>c(CH
3COOH)>c(CH
3COO
-)>c(OH
-)
(5)已知:乙醛、乙醇的沸点分别为20.8℃、78.4℃.从电解后阴极区的溶液中分离出乙醇粗品的方法是
蒸馏
蒸馏
.
(6)在实际工艺处理中,阴极区乙醛的去除率可达60%.若在两极区分别注入1m
3乙醛的含量为3000mg/L的废水,可得到乙醇
1.9
1.9
kg(计算结果保留小数点后1位).

 (2012?海淀区二模)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、电解阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O═CH3CH2OH+CH3COOH实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示.
(2012?海淀区二模)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、电解阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O═CH3CH2OH+CH3COOH实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示.

 (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题: