
题目列表(包括答案和解析)

请回答下列问题:
(1)元素B在周期表中的位置是_________________。J的化学式是__________________。
(2)反应①的离子方程式为___________________。
(3)反应②的化学方程式为_______________。反应③的化学方程式为_______________。
(4)工业上可通过电解熔融的J来制取B的单质,当有6 mol电子发生转移时,可得到________ g单质B。
已知A、C、D、F均是溶液,其中A、C是重要的基础化工原料,C可使酚酞试液变红。B、G、I、J、K是固体,其中B是常见的金属单质,G是常见的非金属单质。E、H是气体,且E是单质。H、J、K、L均是由两种元素组成的化合物,L常温下为液态。物质之间的转化关系如上图所示请回答下列问题:
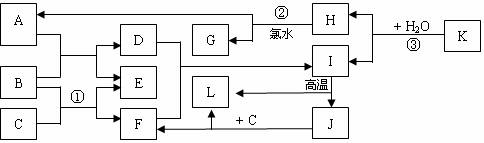
(1)元素B在周期表中的位置是 。J的化学式是 。
(2)反应①的离子方程式为 。
(3)反应②的化学方程式为 。
反应③的化学方程式为 。
(4)工业上可通过电解熔融的J来制取B的单质,当有6mol电子发生转移时,可得到
g单质B。
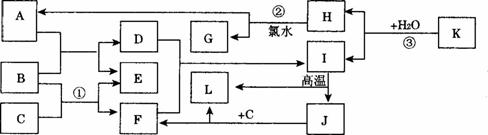
请回答下列问题:
(1)元素B在周期表中的位置是_____________________。J的化学式是___________________。
(2)反应①的离子方程式为_________________________________________________。
(3)反应②的化学方程式为_________________________________________________。
反应③的化学方程式为___________________________________________________。
(4)工业上可通过电解熔融的J来制取B的单质,当有6 mol电子发生转移时,可得到_________g单质B。
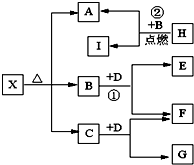 已知X是一种酸式盐,H是常见金属单质,F、I是常见非金属单质,D为淡黄色固体,E、G都是工业上重要的碱性物质,A物质可做耐火材料.它们有如图所示的转化关系.
已知X是一种酸式盐,H是常见金属单质,F、I是常见非金属单质,D为淡黄色固体,E、G都是工业上重要的碱性物质,A物质可做耐火材料.它们有如图所示的转化关系.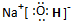
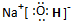
| ||
| ||
已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大。B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同。请回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序是____________(填元素符号)
(2)化合物BD3的分子空间构型可描述为_________,B的原子轨道杂化类型为________。
(3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输。已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物。则F的基态原子价电子排布式为______。CN-与___________(一种分子)互为等电子体,则1个CN-中π键数目为___________。
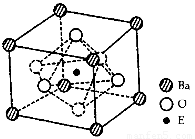
(4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为________
在该晶体中,E4+的氧配为数为____________。若该晶胞边长为a nm可 计算该晶体的密度为__________g/cm3(阿伏加德罗常数为NA)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com