
题目列表(包括答案和解析)


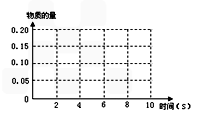
 2CO2(g)+N2(g) 在某温度T1℃下,2L密闭容器中充入NO 、CO各0.4mol,测得不同时间的NO和CO物质的量如下表:
2CO2(g)+N2(g) 在某温度T1℃下,2L密闭容器中充入NO 、CO各0.4mol,测得不同时间的NO和CO物质的量如下表: 
形成酸雨的原理之一可简示如下;
含硫燃料 ![]() A→B→硫酸。
A→B→硫酸。
回答下列问题:
(1)A物质的化学式是________,B物质的化学式是________。
(2)三个反应中不属于氧化还原反应的是________。
(3)SO2中硫元素显+4价,它可能降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”),除去SO2气体,达到减小污染的目的。
(4)从环境保护的角度,雨水的pH<5.6时就判断为酸雨。经测定某次雨水中只含硫酸,且浓度为1×10-5mo1·L-1,则这次降雨________(填“是”或“不是”)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、O2、N2、CO2等。为了除去有害的SO2气体,在英国已进行的一个研究结果表明;高烟囱可以有效降低地表面SO2浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于建造高烟囱的结果,SO2地面浓度降低了30%之多。
Ⅰ.你认为减少酸雨产生的途径可采取的措施是________。
A. 少用煤作燃料 B. 把工厂烟囱造高 C. 燃料脱硫 D. 把工厂迁移到农村 E. 开发新能源
Ⅱ.请从全球环境保护的角度,分析这种建造高烟囱的方法是否可取________,理由是_____________________________________________________。
含硫燃料 ![]() A→B→硫酸。
A→B→硫酸。
回答下列问题:
(1)A物质的化学式是________,B物质的化学式是________。
(2)三个反应中不属于氧化还原反应的是________。
(3)SO2中硫元素显+4价,它可能降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”),除去SO2气体,达到减小污染的目的。
(4)从环境保护的角度,雨水的pH<5.6时就判断为酸雨。经测定某次雨水中只含硫酸,且浓度为1×10-5mo1·L-1,则这次降雨________(填“是”或“不是”)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、O2、N2、CO2等。为了除去有害的SO2气体,在英国已进行的一个研究结果表明;高烟囱可以有效降低地表面SO2浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于建造高烟囱的结果,SO2地面浓度降低了30%之多。
Ⅰ.你认为减少酸雨产生的途径可采取的措施是________。
A. 少用煤作燃料 B. 把工厂烟囱造高 C. 燃料脱硫 D. 把工厂迁移到农村 E. 开发新能源
Ⅱ.请从全球环境保护的角度,分析这种建造高烟囱的方法是否可取________,理由是_____________________________________________________。
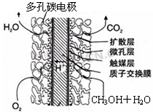
 CH3OH(g)+H2O(g)
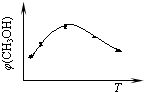
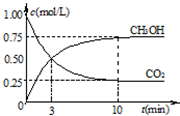
CH3OH(g)+H2O(g) CH3OH(g)+H2O(g)达到平衡状态的是______
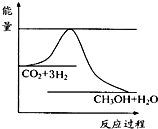
CH3OH(g)+H2O(g)达到平衡状态的是______ CH3OH(g)+H2O(g)进行过程中能量的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是______.
CH3OH(g)+H2O(g)进行过程中能量的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是______.






湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com