
题目列表(包括答案和解析)
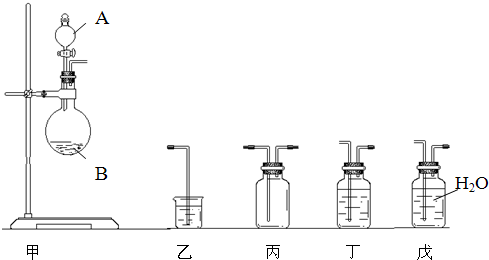

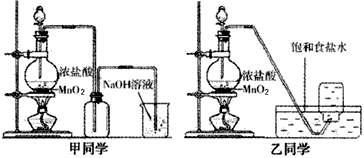

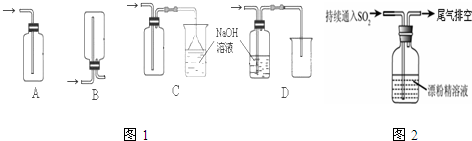
 MnCl2+Cl2+2H2O KClO3+6HCl(浓)→KCl+3Cl2+3H2O待固体完全溶解后,共收集到15.68L的Cl2(标准状况下,假设Cl2无损耗).则残留物中各种物质的质量是______.
MnCl2+Cl2+2H2O KClO3+6HCl(浓)→KCl+3Cl2+3H2O待固体完全溶解后,共收集到15.68L的Cl2(标准状况下,假设Cl2无损耗).则残留物中各种物质的质量是______. 3KClO4+KCl.现取98g KClO3和少量MnO2,充分加热(MnO2不变化),若反应中被氧化的氯元素和被还原的氯元素的物质的量之比为3:13,则标准状况下收集到O2多少升?
3KClO4+KCl.现取98g KClO3和少量MnO2,充分加热(MnO2不变化),若反应中被氧化的氯元素和被还原的氯元素的物质的量之比为3:13,则标准状况下收集到O2多少升?湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com