
题目列表(包括答案和解析)
有A、B、C、D、E、F、G七种常见物质,它们 满足下图所示转化关系。已知:①A、B、C、D含同一种元素;
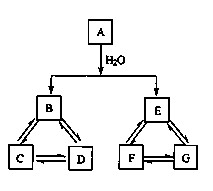
②A、B、C、D、E、F、G都不是氧化物;
③D.G是钠盐
④A、E、F、G含同一种元素,且F 为单质,E 在常温 下为气体。
回答下列问题:
(1)写出A、F的化学式:A_____;F_____。
(2)写出下列反应的离子方程式:
① D → C______________________________;
② C + D → B______________________________。
有A、B、C、D、E、F、G七种常见物质,它们 满足下图所示转化关系。已知:①A、B、C、D含同一种元素;
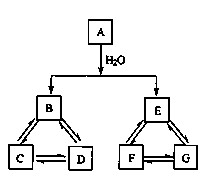
②A、B、C、D、E、F、G都不是氧化物;
③D.G是钠盐
④A、E、F、G含同一种元素,且F 为单质,E 在常温 下为气体。
回答下列问题:
(1)写出A、F的化学式:A_____;F_____。
(2)写出下列反应的离子方程式:
① D → C______________________________;
② C + D → B______________________________。
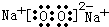
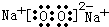


A、B、C、D、E、F、G七种元素均是短周期元素,且原子序数依次增大。A原子无中子, B、G原子的最外层电子数均为其电子层数的两倍,D、G元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙(甲、乙是高中常见的浓酸)均能反应(相对分子质量甲< 乙)转化关系如图(反应条件略去),原子E最外层电子数和其电子层数相等。元素F形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题:

(1)A2D的熔沸点比A2G高的原因是 。B、D、G各一个原子构成每原子均满足8电子的分子,其电子式是 。
(2)E4B3和水反应的化学方程式 。
(3)写出M与甲的浓溶液加热时反应的化学方程式 。
(4)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为 ;X、Y、W都能与Z反应,则Z的结构式为 。
(5)已知CH4 (g)+ 2O2 (g)=CO2 (g)+2H2O (l) △H1=a kJ/mol
欲计算反应CH4 (g)+ 4NO (g)=2N2 (g)+CO2 (g)+2H2O (l)的焓变△H2 , 则还需要查找某化合反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时 △H3 = b kJ/mol,则该反应的热化学方程式为 。
据此计算出△H2 = kJ/mol(用含a和b的式子表示)。
A、B、C、D、E、F、G七种元素均是短周期元素,且原子序数依次增大。A原子无中子, B、G原子的最外层电子数均为其电子层数的两倍,D、G元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙(甲、乙是高中常见的浓酸)均能反应(相对分子质量甲< 乙)转化关系如图(反应条件略去),原子E最外层电子数和其电子层数相等。元素F形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题: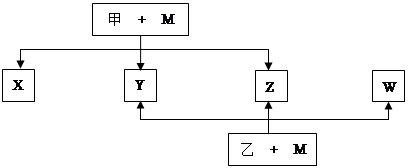
(1)A2D的熔沸点比A2G高的原因是 。B、D、G各一个原子构成每原子均满足8电子的分子,其电子式是 。
(2)E4B3和水反应的化学方程式 。
(3)写出M与甲的浓溶液加热时反应的化学方程式 。
(4)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为 ;X、Y、W都能与Z反应,则Z的结构式为 。
(5)已知CH4 (g)+ 2O2(g)=CO2 (g)+2H2O(l) △H1=a kJ/mol
欲计算反应CH4 (g)+ 4NO (g)=2N2 (g)+CO2 (g)+2H2O(l)的焓变△H2 ,则还需要查找某化合反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时 △H3 =" b" kJ/mol,则该反应的热化学方程式为 。
据此计算出△H2 = kJ/mol(用含a和b的式子表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com