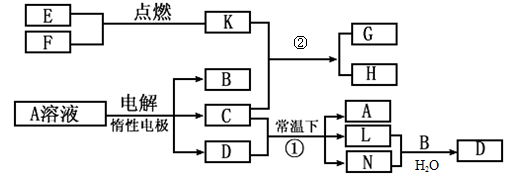
已知A为蓝色溶液,B、C、E、F为单质,其余均为化合物,其中B、L、F常温下为气体,且F为有色气体,C、E为金属,K的水溶液为黄色。各物质转化关系如图。
回答下列问题:
(1)反应②的化学方程式:____________ ;
(2)反应①的离子方程式:_________________;
(3)用惰性电极电解400.00mL A溶液,一段时间内测得溶液pH=1,则需要向溶液中加入__________,其质量为______g,才能使溶液恢复到电解前的状态(不考虑溶液体积变化)。
(4)pH均为4的A溶液和D溶液中,由水电离出的c(H+)之比是_________。
(5)K和A的阳离子对H2O2分解的催化作用,为比较K和A对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
定性分析:如图甲可通过观察气泡产生的快慢可经定性比较得出结论。有同学提出该实验不太合理,其理由是__________________,
定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为__________,实验中需要测量的数据是___________。