(2013?江苏二模)过氧化钙晶体[CaO
2?8H
2O]较稳定,呈白色,微溶于水,能溶于酸性溶液.广泛应用于环境杀菌、消毒等领域.
★过氧化钙晶体的制备
工业上生产CaO
2?8H
2O的主要流程如下:
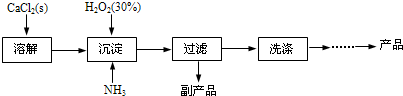
(1)用上述方法制取CaO
2?8H
2O的化学方程式是
CaCl2+H2O2+2NH3+8H2O=CaO2?8H2O↓+2NH4Cl
CaCl2+H2O2+2NH3+8H2O=CaO2?8H2O↓+2NH4Cl
.
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH
3,其可能原因分别是
①
温度低可减少过氧化氢的分解,提高过氧化氢的利用率(或防止过氧化氢的分解)
温度低可减少过氧化氢的分解,提高过氧化氢的利用率(或防止过氧化氢的分解)
;②
通入过量NH3使溶液呈碱性,抑制CaO2?8H2O的溶解(或使溶液呈碱性,减少CaO2?8H2O的溶解,或提高产品的产率.意思相近均给分)
通入过量NH3使溶液呈碱性,抑制CaO2?8H2O的溶解(或使溶液呈碱性,减少CaO2?8H2O的溶解,或提高产品的产率.意思相近均给分)
.
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30mL蒸馏水和10mL 2.000mol?L
-1 H
2SO
4,用0.0200mol?L
-1KMnO
4标准溶液滴定至终点.重复上述操作两次.H
2O
2和KMnO
4反应的离子方程式为2MnO
4-+5H
2O
2+6H
+=2Mn
2++5O
2↑+8H
2O
(3)滴定终点观察到的现象为
当滴入最后一滴KMnO4标准溶液后溶液由无色变浅红色,且30s不褪色
当滴入最后一滴KMnO4标准溶液后溶液由无色变浅红色,且30s不褪色
.
(4)根据表1数据,计算产品中CaO
2?8H
2O的质量分数(写出计算过程)
表1.KMnO
4标准溶液滴定数据
| 滴定次数 |
样品的质量/g |
KMnO4溶液的体积/mL |
| 滴定前刻度/mL |
滴定后刻度/mL |
| 1 |
0.3000 |
1.02 |
24.04 |
| 2 |
0.3000 |
2.00 |
25.03 |
| 3 |
0.3000 |
0.20 |
23.24 |
根据关系式:5(CaO
2?8H
2O)~5H
2O
2~2KMnO
4;n(KMnO
4)=
n(CaO
2?8H
2O)=
×0.0200 mol?L
-1×23.03mL×10
-3L?mL
-1=1.151×10
-3 mol、故 CaO
2?8H
2O的质量分数为:
| 1.51×10-3mol×216g?mol-1 |
| 0.3000g |
×100%=82.91%.
根据关系式:5(CaO
2?8H
2O)~5H
2O
2~2KMnO
4;n(KMnO
4)=
n(CaO
2?8H
2O)=
×0.0200 mol?L
-1×23.03mL×10
-3L?mL
-1=1.151×10
-3 mol、故 CaO
2?8H
2O的质量分数为:
| 1.51×10-3mol×216g?mol-1 |
| 0.3000g |
×100%=82.91%.
.

