
题目列表(包括答案和解析)
(13分)某校化学兴趣小组对课本实验结论“葡萄糖与新制氢氧化铜共热生成红色的Cu2O沉淀”提出质疑,认为红色沉淀不一定就是氧化亚铜。为了确定红色沉淀的成分,开展了相关探究。
[一]提出猜想,请你完成猜想2、3。
猜想1、红色沉淀可能是Cu;
猜想2、 ;
猜想3、 。
[二]查阅资料:①Cu20属于碱性氧化物②Cu+在酸I生条件下能发生自身氧化还原反应
[三]制备红色沉淀:①制备氢氧化铜悬浊液②氢氧化铜悬浊液与葡萄糖共热③过滤、洗涤、低温烘干得红色粉末
[四]红色沉淀成分探究:该小组同学设计了三种方案:
方案Ⅰ:取该红色粉末溶于足量稀硝酸中,观察溶液颜色变化。
方案Ⅱ:取该红色粉末溶于足量稀硫酸中,观察是否有残渣。
方案Ⅲ:装置如图所示:(夹持仪器略去)
试回答下列问题:
(1)请分别评价方案I和方案Ⅱ是否合理(填“是”或“否”),并完成相关反应方程式:
方案I: ,写出Cu20与稀硝酸反应的化学方程式 ;
方案Ⅱ: ,写出反应的离子方程式 。
(2)实际上,方案Ⅲ的装置尚存在明显的缺陷,应在A和B之问添加 。
(3)方案Ⅲ中,探究小组的同学在锥形瓶中加入少量硫酸铜溶液,其目的是 。
(4)方案Ⅲ中,若要测定红色粉末的成分,需要测定下列哪些物理量 (填序号)。
①反应前红色粉末与硬质玻璃管的总质量 ②实验前干燥管的质量 ③实验后干
燥管的质量 ④硬质玻璃管的质量 ⑤锌粒质量 ⑥稀硫酸的物质的量浓度
(13分)某校化学兴趣小组对课本实验结论“葡萄糖与新制氢氧化铜共热生成红色的Cu2O沉淀”提出质疑,认为红色沉淀不一定就是氧化亚铜。为了确定红色沉淀的成分,开展了相关探究。
[一]提出猜想,请你完成猜想2、3。
猜想1、红色沉淀可能是Cu;
猜想2、 ;
猜想3、 。
[二]查阅资料:①Cu20属于碱性氧化物②Cu+在酸I生条件下能发生自身氧化还原反应
[三]制备红色沉淀:①制备氢氧化铜悬浊液②氢氧化铜悬浊液与葡萄糖共热③过滤、洗涤、低温烘干得红色粉末
[四]红色沉淀成分探究:该小组同学设计了三种方案:
方案Ⅰ:取该红色粉末溶于足量稀硝酸中,观察溶液颜色变化。
方案Ⅱ:取该红色粉末溶于足量稀硫酸中,观察是否有残渣。
方案Ⅲ:装置如图所示:(夹持仪器略去)
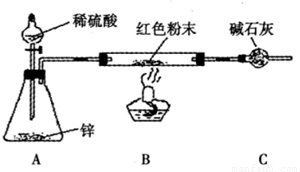
试回答下列问题:
(1)请分别评价方案I和方案Ⅱ是否合理(填“是”或“否”),并完成相关反应方程式:
方案I: ,写出Cu20与稀硝酸反应的化学方程式 ;
方案Ⅱ: ,写出反应的离子方程式 。
(2)实际上,方案Ⅲ的装置尚存在明显的缺陷,应在A和B之问添加 。
(3)方案Ⅲ中,探究小组的同学在锥形瓶中加入少量硫酸铜溶液,其目的是 。[来源:学_科_网Z_X_X_K]
(4)方案Ⅲ中,若要测定红色粉末的成分,需要测定下列哪些物理量 (填序号)。
①反应前红色粉末与硬质玻璃管的总质量 ②实验前干燥管的质量 ③实验后干
燥管的质量 ④硬质玻璃管的质量 ⑤锌粒质量 ⑥稀硫酸的物质的量浓度
(13分)某同学设计了如右下图的实验装置来粗略地测定电石中碳化钙的质量分数。
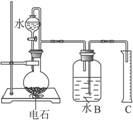
(1)烧瓶中发生反应的化学方程式为____________________________________________;装置B、C的作用是_________________________________,烧瓶要干燥,放入电石后应塞紧橡皮塞,这是为了_________________________________。
(2)所用电石质量不能太大,否则_________________________________,也不能太小,否则 _________________________________;若容器B的容积为250 mL,则所用电石的质量应在___________ g左右(选填:0.03,0.60,1.00,1.50,2.00)。
(3)由分液漏斗往烧瓶里滴加水的操作方法是________________________________。
(4)实验中测得排入量筒中水的体积为V mL、电石的质量为W g,则电石中碳化钙的质量分数是___________%(不计算导管中残留的水,气体中饱和的水蒸气等也忽略不计)。
(13分) 某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在”。为此,他们设计了如下图所示的装置。回答下列问题: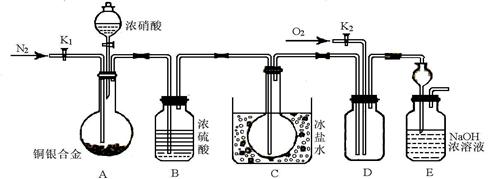
(1)写出A中Cu与HNO3反应可能的离子方程式 。
(2)实验前先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,其目的是 ;装置中B瓶的作用是 。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是 ;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”) 的O2。
(4)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L-1;实验后A溶液:V=40mL c(H+)=1.0 mol·L-1。假设反应中HNO3 既无挥发也无分解,则:①参加反应的HNO3的物质的量为 mol
②若已测出反应后E装置的生成物中含氮元素的质量m克,则为确定合金中Cu的质量分数还需测定的数据是 ,若测得该数据为n,写出合金中铜的质量(设为x克)的求算式子(只需列式子,不需解方程) 。
(5)为减小上述实验误差,在D中观察到实验现象后还须进行的操作是 。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。只利用A装置中反应后的溶液进行简单的操作,也可以确定合金中Cu的质量分数,其实验操作过程为
。
(13分) 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去):
A KMnO4溶液 B
试回答:
(1)上述反应中生成二氧化硫的化学方程式为 ______________ ;
(2)乙同学认为还可能产生氢气的化学方程式是 ;
(3)丙同学在安装好装置后,必不可少的一步操作是: ;
(4)A中加入的试剂可能是 ,作用是_____ ;
B中加入的试剂可能是 ,作用是 ___________ ;
E中加入的试剂可能是 ,作用是 ___________ 。
(5)可以证明气体X中含有氢气的实验现象是:
C中:_____________________;D中:_____________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com