
题目列表(包括答案和解析)
高锰酸钾(KMnO4)在酸性条件下有很强的氧化性,它在常温下就能将Cl-氧化为Cl2,![]() 被还原成Mn2+,写出高锰酸钾跟浓盐酸在室温下反应制取氯气的化学方程式________.
被还原成Mn2+,写出高锰酸钾跟浓盐酸在室温下反应制取氯气的化学方程式________.
| ||
| ||
| O | - 4 |
| ||
| ||
| CuCl2 | ||
|
| CuCl2 | ||
|
(1)实验室用二氧化锰跟浓盐酸在加热条件下反应制取氯气;高锰酸钾是常用氧化剂,用高锰酸钾跟浓盐酸反应在室温下也能制氯气,方程式为:
________KMnO4+________HCl![]() ________MnCl2+________KCl+________Cl2↑+________H2O
________MnCl2+________KCl+________Cl2↑+________H2O
先配平该方程式,再用单线桥标出该反应中电子转移的方向和数目
该反应方程式中氧化剂是________(填化学式),氧化产物是________(填化学式).作氧化剂与作还原剂的物质的量之比为________
(2)在常温下,发生下列几种反应:
①16H++10Z-+2XO![]()
![]() 2X2++5Z2+8H2O
2X2++5Z2+8H2O
②2A2++B2![]() 2A3++2B-
2A3++2B-
③2B-+Z2![]() B2+2Z-
B2+2Z-
根据上述反应,XO![]() 、Z2、B2、A3+氧化性从强到弱的顺序为:________
、Z2、B2、A3+氧化性从强到弱的顺序为:________
(1)实验室常用二氧化锰和浓盐酸反应制取氯气,反应方程式是________.
(2)高锰酸钾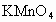 在酸性条件下有很强的氧化性,它在常温下就能将
在酸性条件下有很强的氧化性,它在常温下就能将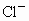 氧化为
氧化为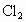 ,
,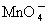 被还原成
被还原成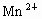 ,写出高锰酸钾跟浓盐酸在室温下反应制取氯气的化学方程式______________________________.
,写出高锰酸钾跟浓盐酸在室温下反应制取氯气的化学方程式______________________________.
(3)历史上曾用“地康法”制氯气.这一方法用 作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气.反应的化学方程式是_______
作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气.反应的化学方程式是_______
__________________.
(4)从氯元素化合价变化看,以上三种方法的共同点是________________.
(5)比较以上三个反应,可认为氧化剂的氧化能力从强到弱的顺序为_____________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com