[化学-选修1化学与生活]化学与人类的生产、生活及环境都密切相关.
Ⅰ.下表是某食品包装上的说明,表中列出了部分配料.
| 品 名 |
浓缩菠萝汁 |
| 配 料 |
①浓缩菠萝汁 ②蔗糖 ③柠檬黄 ④山梨酸钾 ⑤水 |
| 果汁含量 |
≥80% |
| 生产日期 |
标于包装封口处 |
(1)配料中,属于着色剂的是______(填序号,下同),属于防腐剂的是______,属于调味剂的是______.
(2)从上表中可以分析得知,该食品主要提供______等三种营养素.
Ⅱ.(1)我国中南地区,通常情况下,雨水量相同的元月份与8月份比较,______(填:“前者”或“后者”)的雨水的酸性较高.
(2)汽车尾气需要用催化转换器减少有毒气体的排放.写出汽车尾气中CO、NO相互作用生成可参与大气循环的气体的化学方程式:______.
(3)用氯气对居民饮用水进行消毒已有百年历史,但科学研究表明,用氯气对自来水消毒时,氯气能和水中的微量有机物反应生成氯代烃等多种有毒物质.因此,逐步被具有不同优点的铁酸钠(Na
2FeO
4)、氯胺(NH
2Cl)、二氧化氯(ClO
2)等消毒剂所替代.?
①铁酸钠(Na
2FeO
4)起消毒作用后,它同时具有净水作用,其理由:______(用离子方程式表示).
②氯胺(NH
2Cl)比次氯酸稳定,可与水作用逐步产生次氯酸,用化学方程式表示氯胺与水的反应:______.
③二氧化氯(ClO
2)具有很强的氧化性,与Cl
2相比是一种高效消毒剂,其原因是______.
Ⅲ.阅读并回答问题:
2009年12月哥本哈根气候变化峰会的主题是减少二氧化碳的排放、控制温室效应.世界上没有垃圾,只有放错了地方的财富.人类在认识到二氧化碳副作用的同时,应积极寻找并拓展其利用空间.上海世博会已成为低碳世博会.“四川馆”率先采用世界上最新的建筑装饰材料--大豆纤维.中国是唯一拥有“大豆纤维”完全知识产权的国家.“大豆纤维”主要原料是大豆蛋白质和高分子聚乙烯醇,它属于可降解性再生植物蛋白纤维,该纤维具有天然纤维和化学纤维的许多优良性能,被国内外专家誉为“21世纪健康舒适型纤维”.
下列说法不正确的是______
A.二氧化碳无毒、分子结构稳定,它可以用于做焊接保护气体.
B.发展二氧化碳地质封存技术并将其与石油开采结合起来,既能减少二氧化碳排放,又实现了石油的绿色开发.
C.从空气中提取CO
2,成本较高,如果从冶金、火力发电等工厂排放的烟气中提取二氧化碳,提取成本将大大降低.
D.碳酸饮料中的二氧化碳能够被人体吸收,不会排放到空气中去.
E.不能使用含生物酶的洗涤剂洗涤大豆纤维布料的衣服.
F.大豆纤维是利用大豆中的油脂通过聚合反应合成的.
G.大豆纤维属于合成高分子化合物.
H.废弃的大豆纤维可能造成“白色污染”,最好用填埋法处理.

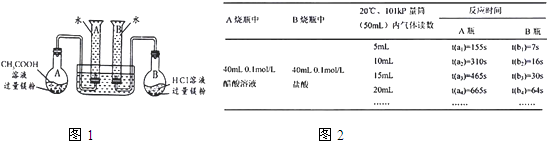
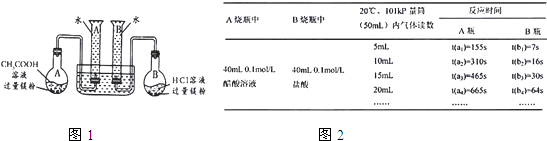
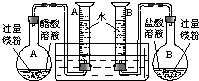 (2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.
(2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.