(2013?盐城一模)碳酸镁晶须是一种新型吸波隐形材料中的增强材料.
(1)合成碳酸镁晶须的步骤如下:
步骤1.配制0.5mol?L
-1MgSO
4溶液和0.5mol?L
-1NH
4HCO
3溶液.
步骤2.量取500mL NH
4HCO
3溶液于1 000mL四口烧瓶中,开启搅拌器.温度控制在50℃.
步骤3.将250mL MgSO
4溶液逐滴加入NH
4HCO
3溶液中,用氨水调节溶液pH到9.5.
步骤4.放置1h后,过滤,洗涤干净.
步骤5.在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO
3?nH
2O n=1~5).
①步骤2控制温度在50℃,较好的加热方法是
水浴加热
水浴加热
.
②步骤3生成MgCO
3?nH
2O沉淀的离子方程式为
Mg2++HCO3-+NH3?H2O+(n-1)H2O═MgCO3?nH2O+NH4+
Mg2++HCO3-+NH3?H2O+(n-1)H2O═MgCO3?nH2O+NH4+
.
⑧步骤4检验沉淀已经洗涤干净的方法是
取最后一次洗涤的滤出液,滴入盐酸酸化的BaCl2溶液,若无沉淀说明已洗涤干净
取最后一次洗涤的滤出液,滴入盐酸酸化的BaCl2溶液,若无沉淀说明已洗涤干净
.
(2)测定合成的MgCO
3?nH
2O中的n值.
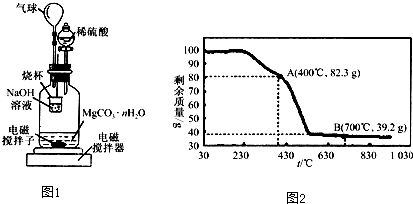
称量1.000g碳酸镁晶须,放入图所示的广口瓶中,加入水,滴入稀硫酸与晶须反应,生成的CO
2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后,烧杯中的溶液用已知浓度的盐酸滴定,测得CO
2的总量;重复上述操作2次.
①图中气球的作用是
缓冲压强并封闭体系
缓冲压强并封闭体系
.
②上述反应后期要升温到30℃,主要目的是
使广口瓶内水中溶解的CO2充分逸出,并被NaOH充分吸收
使广口瓶内水中溶解的CO2充分逸出,并被NaOH充分吸收
.
③设3次实验测得每1.000g碳酸镁晶须产生的CO
2平均值为a mol,则n值为
(用含a的代数式表示).
(3)称取100g上述晶须产品进行热重分析,热重曲线如图2,则该条件下合成的晶须中,n=
1
1
(填“1”“2”“3”“4”或“5”).



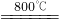 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑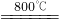 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑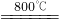 MgO+S↑+3CO↑
MgO+S↑+3CO↑