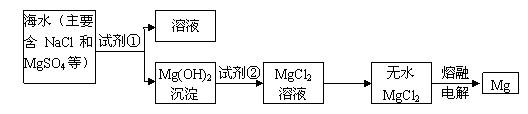海洋约占地球表面积的71%,海水化学资源的利用具有非常广阔的前景.
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、
过滤
过滤
、
蒸发
蒸发
可制得精盐.
(2)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如图1所示:
①为了使MgSO
4转化为Mg(OH)
2,试剂①可以选用
氢氧化钠(NaOH)
氢氧化钠(NaOH)
,要使MgSO
4完全转化为沉淀,加入试剂①的量应
过量
过量
;
②试剂②可以选用
盐酸
盐酸
;
③试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是
C
C
.
A.Mg(OH)
2MgO
Mg
B.Mg(OH)
2MgO
Mg
C.Mg(OH)
2MgCl
2Mg
D.Mg(OH)
2MgCl
2Mg
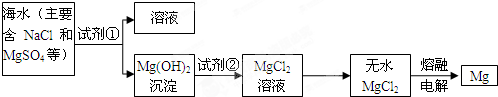
(3)溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作.工业以浓缩海水为原料提取溴的部分过程如图2所示.
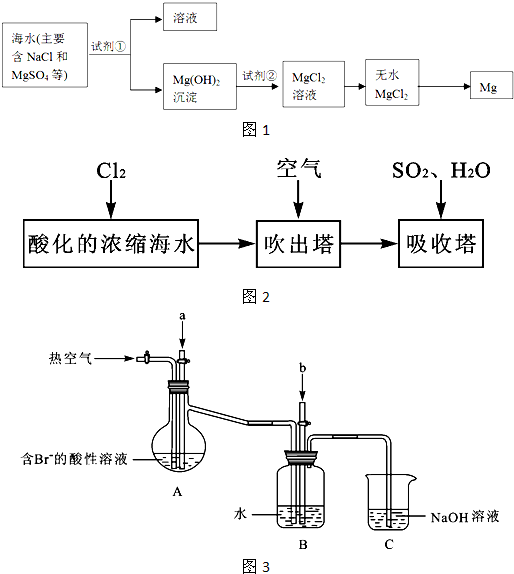
某课外小组在实验室模拟上述过程设计如图3所示装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
①A装置中通入a气体的目的是(用离子方程式表示)
Cl2+2Br-=2Cl-+Br2
Cl2+2Br-=2Cl-+Br2
;
②A装置中通入a气体一段时间后,停止通入,改通热空气.通入热空气的目的是
吹出Br2
吹出Br2
;
③反应过程中,B装置中有SO
42-生成.检验SO
42-的方法是
取少量B装置中反应后的溶液于试管中,滴加氯化钡溶液,产生白色沉淀,证明有SO42-
取少量B装置中反应后的溶液于试管中,滴加氯化钡溶液,产生白色沉淀,证明有SO42-
;
④C装置的作用是
吸收未反应的Cl2、Br2和SO2
吸收未反应的Cl2、Br2和SO2
.