
题目列表(包括答案和解析)
混合相同物质的量浓度的200mL![]() 溶液和150mL
溶液和150mL![]() 溶液,最终所得溶液中各离子物质的量浓度的大小顺序是
溶液,最终所得溶液中各离子物质的量浓度的大小顺序是
[
]
| A、相同物质的量浓度的醋酸溶液和氢氧化钠溶液等体积混合 | B、相同物质的量浓度的盐酸和氨水等体积混合 | C、pH=3的硫酸溶液和pH=11的氨水等体积混合 | D、pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 |
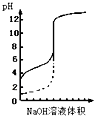
| A、△H>0的反应,常温下一定不能自发进行 | B、用0.1mol/L NaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 | C、等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | D、恒容密闭容器中进行的反应3A(g)?B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将减小 |
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com