
题目列表(包括答案和解析)
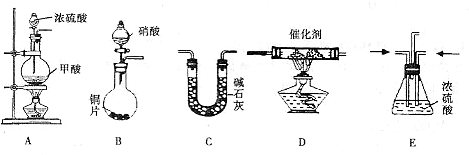
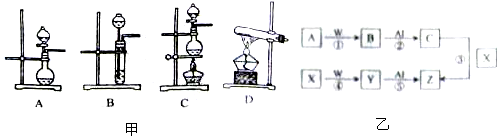
I .如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题.


(1) 选用A装置可制取的气体有 ,选用B装置可制取的气有 ,
通常选用C装置制取的气体有 。
(2) 写出利用上述有关药品制取氨气的化学方程式: 。
若要制得干燥的氨气,可选用下列干燥剂中的 (填序号)
a. 生石灰 b. 浓硫酸 C. 五氧化二磷 d. .碱石灰
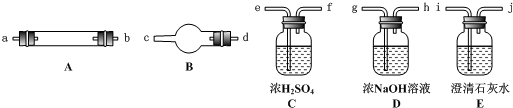
II. (3) 实验室制取的一氧化氮气体利用右图装置选用必要试剂如何进行收集?
。
III.(4) 现安装一套实验室利用液一液反应制备气体的装置。有人设计了五步操作,请你安排出正确而简捷的程序,将序号填入括号内。
( )将蒸馏烧瓶固定在铁架台上。
( )把酒精灯放在铁架台上,根据酒精灯确定铁圈的高度,固定铁圈,放好石棉网。
( )用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集器中。
( )检查装置的气密性(利用对固定装置进行微热的方法来检查气密性,假定瓶口漏气而需要更换橡皮塞)。
( )在蒸馏烧瓶上装好分液漏斗,连接好导气管。
| ||
| △ |
 ( )→( )→( )→收集气体
( )→( )→( )→收集气体| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
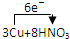 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O
| ||
| ||
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| 高温 |
| 一定条件 |
| 编号 | 实验内容 | 实验原理 | 气体发生装置 |
| ① | 制氧气 | H2O2→O2 | |
| ② | 制氨气 | NH4Cl→NH3 | |
| ③ | 制氯气 | HCl→Cl2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com