(1)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g) 2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
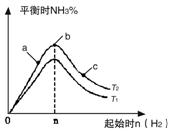
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是__________。
②若容器容积为1L,n=3mol,反应达到平衡时H2的转化率为60%,则在起始时体系中加入N2的物质的量为__________mol,此条件下(T2),反应的平衡常数K=__________。
③图像中T2和T1的关系是__________。(填“高于”、“低于”、“等于”、“无法确定”)。
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
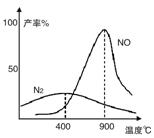
4NH3+5O2 4NO+6H2O
4NO+6H2O
4NH3+3O2 2N2+6H2O
2N2+6H2O
温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是__________。
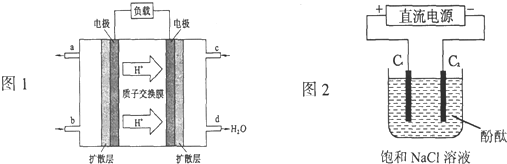
(3)现以H2与O2、熔融盐Na2CO3组成的燃料电池(如图所示,其中Y为CO2)装置进行电解。
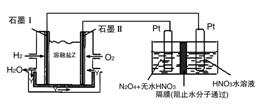
写出石墨Ⅰ电极上发生反应的电极反应式:__________。
在电解池中生成N2O5的电极反应式为:__________。

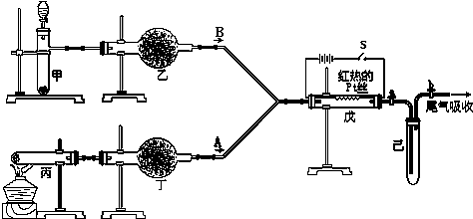
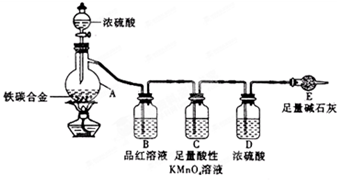 某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题.
某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题.
![]() 2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):

![]() 4NO+6H2O
4NO+6H2O ![]() 2N2+6H2O
2N2+6H2O