
题目列表(包括答案和解析)
(14分)水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的炭制得:C (s) + H2O(g) CO (g) +H2 (g) △H=+131kJ?mol-1
CO (g) +H2 (g) △H=+131kJ?mol-1
⑴T温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
| 容器 编号 | c(H2O) /mol·L-1 | c(CO) /mol·L-1 | c(H2) /mol·L-1 | v正、v逆比较 |
| I | 0.06 | 0.60 | 0.10 | v正=v逆 |
| II | 0.06 | 0.50 | 0.40 | ① |
| III | 0.12 | 0.40 | 0.80 | v正<v逆 |
| IV | 0.12 | 0.30 | ② | v正=v逆 |
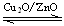 CH3OH(g) △H>0给合成甲醇反应体系中通入少量CO则平衡向 移动,减小压强则平衡向 移动,降低温度则平衡向 移动(填左,右,不)
CH3OH(g) △H>0给合成甲醇反应体系中通入少量CO则平衡向 移动,减小压强则平衡向 移动,降低温度则平衡向 移动(填左,右,不)可以证明可逆反应N2(g)+3H2(g) 2NH3(g)已达平衡状态的是:①一个N≡N键断裂的同时,有3个H-H键断裂;②一个N≡N键断裂的同时,有6个N-H键断裂;③其他条件不变时,混合气体的总质量不变;④恒温恒容下的反应,体系压强不再改变;⑤反应体系中反应物和生成物的百分含量都不再改变;⑥恒温恒压下的反应,密度不再改变;⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)( )
2NH3(g)已达平衡状态的是:①一个N≡N键断裂的同时,有3个H-H键断裂;②一个N≡N键断裂的同时,有6个N-H键断裂;③其他条件不变时,混合气体的总质量不变;④恒温恒容下的反应,体系压强不再改变;⑤反应体系中反应物和生成物的百分含量都不再改变;⑥恒温恒压下的反应,密度不再改变;⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)( )
A.全部 B.②④⑤⑥⑦ C.②③④⑤⑥⑦ D.③④⑤⑥⑦
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com