
题目列表(包括答案和解析)
| 实验目的 | 试验方法 |
| 检验氯化亚铁是否变质 | D D |
| 除去食盐中少量细沙 | C C |
| 除去碳酸钠固体中少量碳酸氢钠 | A A |
| 除去镁粉中混有的少量铝粉 | B B |
①粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌过滤器中的液体 ②利用固、液反应物混合的方法制取H2或O2,可采用相同的发生装置 ③利用饱和食盐水,可除去氯气中混有的氯化氢气体 ④向稀硫酸中加入废铁屑,然后加热蒸干即可得硫酸亚铁晶体 ⑤测定硫酸铜晶体中结晶水含量时至少需要称量4次 ⑥某无色溶液中加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有![]() 存在
存在
A.①②③ B.①③⑤ C.②④⑥ D.②③⑤
下列实验操作或实验方案中正确的是( )
①粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌过滤器中的液体
②利用固、液反应物混合的方法制取H2或O2,可采用相同的发生装置
③利用饱和食盐水,可除去氯气中混有的氯化氢气体
④向稀硫酸中加入废铁屑,然后加热蒸干即可得硫酸亚铁晶体
⑤测定硫酸铜晶体中结晶水含量时至少需要称量4次
⑥某无色溶液中加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有
SO2-4存在
A.①②③ B.①③⑤
C.②④⑥ D.②③⑤
(Ⅰ)下列实验操作或对实验事实的描述正确的是 (填序号);
① 实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
② 配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低。
③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末
④ 实验室用铜片与稀硝酸反应产生的气体可用排水法收集
⑤ 试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
⑥ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑦ 苯与溴水在铁粉的催化作用下制备溴苯
⑧ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
Ⅱ.在中学化学实验中,通常用无水硫酸铜来检验少量水的存在。由于无水硫酸铜吸湿性很强,需要现制现用。
方法甲:取2药匙细小的硫酸铜晶体置于_______中研碎后放入坩埚,将坩埚放在______上用小火慢慢加热并用玻璃棒不停搅拌,最后将坩埚移入___________中进行冷却(请选用合适仪器填空:表面皿、研钵、烧杯、通风橱、试管夹、干燥器、泥三角)。
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20 mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5 min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干。
【交流与讨论】
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是_________(用化学方程式表示)。
(2)方法乙中,浓硫酸的作用是__________;为了不浪费药品,对无水乙醇洗涤液进行再生的方法是______ ,所用的主要玻璃仪器有烧瓶、接液管、锥形瓶、酒精灯________________等。
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想______________。
 (4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
(4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
【问题一】如图装置中,分液漏斗内装的液体是________,反应结束时,获取CuSO4•5H2O的操作过程是先________________,趁热将三颈瓶中的液体倒入烧杯中冷却,析出晶体CuSO4?5H2O ,过滤、晾干。
【问题二】工业上用石灰乳吸收尾气,除了防止环境污染外,还能得到了有经济实用价值的副产品―― 亚硝酸钙。尾气吸收生成亚硝酸钙的化学方程式是_______________。
以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵[(NH4)2S2O8]和氧化铁红颜料, 原料的综合利用率较高。其主要流程如下:
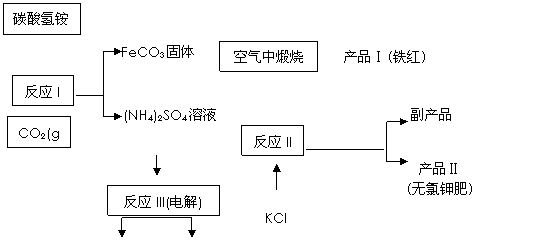 | |||
| |||
|
(1)①反应I前需在FeSO4 溶液中加入 ,以除去溶液中的Fe3+;
②反应I需控制反应温度低于35℃,其目的是 。
(2) ①反应II所得的副产品是 ;试写出该副产品的一种用途为 。
②检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
。
(3)煅烧FeCO3生成产品I的化学反应方程式为________________________。实验室进行煅烧操作所需仪器除了酒精灯、泥三角、三脚架、玻璃棒外,还有 。
(4)反应III常被用于电解生产(NH4)2S2O8 (过二硫酸铵)。电解时均用惰性电极,阳极 发生的电极反应可表示为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com