
题目列表(包括答案和解析)

| 一定条件 |


| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 341 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
 根据元素周期表及周期律的知识回答下列问题:
根据元素周期表及周期律的知识回答下列问题:| 一定条件 |
根据元素周期表及周期律的知识回答下列问题:
(1)与钠同周期且单质熔点最高的元素位于周期表的第_________周期第_________族。
(2)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H2 2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
(3)元素周期表中元素的性质存在递变规律,下列比较正确的是________。
a.离子半径:Na+>Mg2+>S2->Cl-
b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl
d.还原性:PH3>H2S>HCl>HF
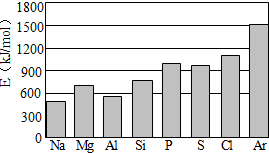
(4)第三周期元素的气态原子失去最外层一个电子所需能量(设为E)如下图所示:
①同周期内,随着原子序数的增大,E值变化的总趋势是__________________。
②根据上图提供的信息,试推断E氟_______E氧(填“>”“<”或“=”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com