(2009?汕头二模)甲酸(CH
2O
2),俗称蚁酸,结构式为:
.某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了相关实验加以验证:
猜想I:甲酸具有酸性;
实验I:在甲酸溶液中滴加紫色石蕊试液;
猜想II:甲酸能发生银镜反应;
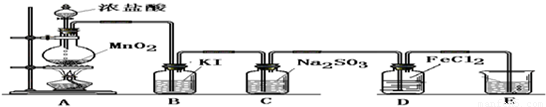
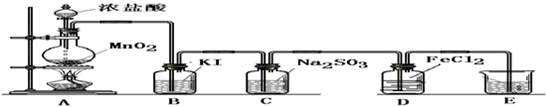
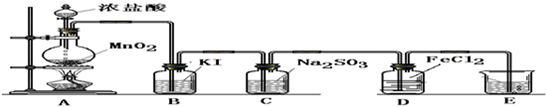
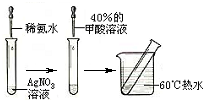
实验II:操作过程如右图所示;
回答下列问题:
(1)请你再设计出至少2个实验方案来验证甲酸的酸性:
测定pH或滴加Na2CO3溶液
测定pH或滴加Na2CO3溶液
、
或将甲酸滴加到滴有酚酞的NaOH溶液中
或将甲酸滴加到滴有酚酞的NaOH溶液中
;
(2)请你进一步设计实验方案证明甲酸是弱酸
测定HCOONa溶液的pH;或将等pH的HCOOH溶液和HCl溶液稀释相同倍数,测其pH的变化;或比较等浓度甲酸和盐酸的导电性等
测定HCOONa溶液的pH;或将等pH的HCOOH溶液和HCl溶液稀释相同倍数,测其pH的变化;或比较等浓度甲酸和盐酸的导电性等
;
(3)依右上图所示的实验,加热20分钟后并没有出现预期的实验现象.该小组同学预期的实验现象是
出现银镜
出现银镜
,请你从理论上简单解释实验中没有出现该现象的原因
由于羟基对醛基的影响,导致甲酸中的醛基不具有典型醛基的性质;羧基中C原子和2个O原子之间形成1个大л键,而使甲酸分子中的醛基性质不太典型;或答稀氨水量不足,使甲酸与银氨溶液混合后仍显酸性
由于羟基对醛基的影响,导致甲酸中的醛基不具有典型醛基的性质;羧基中C原子和2个O原子之间形成1个大л键,而使甲酸分子中的醛基性质不太典型;或答稀氨水量不足,使甲酸与银氨溶液混合后仍显酸性
;
(4)在仔细分析甲酸分子组成元素的基础上,请你再提出一个甲酸在浓硫酸作用下可能具有的性质的猜想并设计一个实验方案验证你的猜想:
①你提出的猜想是
甲酸在浓硫酸的作用下脱水生成CO和H2O
甲酸在浓硫酸的作用下脱水生成CO和H2O
;
②你设计的实验方案是:
实验方案请参考如下形式:


 (2009?汕头二模)甲酸(CH2O2),俗称蚁酸,结构式为:
(2009?汕头二模)甲酸(CH2O2),俗称蚁酸,结构式为:




 甲酸(CH2O2),俗称蚁酸,结构式为:
甲酸(CH2O2),俗称蚁酸,结构式为: