
题目列表(包括答案和解析)
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |


(1)阴影部分元素N在元素周期表中的位置为第________周期第________族。根据元素周期律,请你预测,H3AsO4、H3PO4的酸性强弱:H3AsO4________H3PO4(填“>”、“<”或“=”)。
(2)根据NaH的存在,有人提议可把氢元素放在第ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的第________族。
(3)元素甲是第三周期金属元素中原子半径最小的元素,该元素的离子与过量氨水反应的离子方程式为:____________________________。
(4)周期表中有10多种人体所需的微量元素,其中有一种被誉为“生命元素”的主族元素R,对延长人类寿命起着重要作用.已知R元素的原子有4个电子层,其最高价氧化物的分子式为RO3,则R元素的名称为________。
A.硫 B.砷 C.硒 D.硅
(5)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构,用电子式表示羰基硫分子的形成过程:_______________________________________。
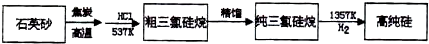
| |||||||||||||||||||||||||||||||||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com