
题目列表(包括答案和解析)
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素的原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物ACD3与其氢化物CA3反应生成一种盐X,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。
请回答下列问题:
(1)由A、B、D、E四种元素组成的某无机化合物Y受热易分解。写出少量Y溶液与足量Ba(OH)2溶液反应的离子方程式 。
(2)将铝片和镁片用导线连接,插入由A、D、E三种元素组成的稀溶液中构成原电池,则负极的电极反应式为 。
(3)常温下,ACD3的稀溶液与CA3的水溶液混合,可能出现的结果是 。
①pH<7,c(H+)>c(CD![]() )> c(OH-)> c(CA
)> c(OH-)> c(CA![]() )
)
②pH<7,c(CD![]() ) >c(OH-)=c(H+)> c(CA
) >c(OH-)=c(H+)> c(CA![]() )
)
③①pH>7,c(CA![]() )> c(OH-) >c(CD
)> c(OH-) >c(CD![]() )>c(H+)
)>c(H+)
④①pH<=7,c(CA![]() )>c(CD
)>c(CD![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
(4)对可逆反应3A2(g)+C2(g) ![]() 2CA3(g),当反应达到平衡时,不断改变条件(不改变A2、C2、CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是 。
2CA3(g),当反应达到平衡时,不断改变条件(不改变A2、C2、CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是 。
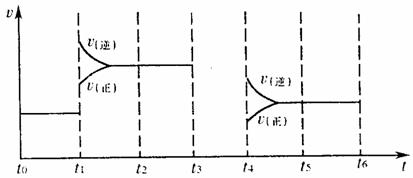
(5)温度为T℃时,将4amolA2和2amolC2放入1L密闭容器中,充分反应后测得C2的转化率为50%,则该反应的平衡常数为 。
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是 。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。
(3)A、B、D、E四种元素组成的某无机化合物浓度为 0.1 mol/L时, pH最接近 。
A.5.6 B.7.0 C.8.4 D.13.0
(4)化学反应3A2(g)+C2(g)![]() 2CA3(g)。ΔH=-92.4kJ·mol-1
2CA3(g)。ΔH=-92.4kJ·mol-1
|
和CA3的量),右图表示反应速率与反应过程的关
系,其中表示平衡混合物中CA3的含量最高的一段
时间是 。
②温度为T℃时,将4amolA2和2a molC2放入1L
密闭容器中,充分反应后测得C2的转化率为50%,
则反应的平衡常数 。
③在500℃、2.02×107Pa和铁催化条件下向一密闭容器中充入1molC2和3molA2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是________ ____;
(5)已知0.4mol 液态C2 A4与足量的液态双氧水反应,生成C2和水蒸气,放出256.65 kJ
的热量。写出该反应的热化学方程式 。
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素的原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物ACD3与其氢化物CA3反应生成一种盐X,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.
请回答下列问题:
(1)由A、B、D、E四种元素组成的某无机化合物Y受热易分解.写出少量Y溶液与足量Ba(OH)2溶液反应的离子方程式________.
(2)将铝片和镁片用导线连接,插入由A、D、E三种元素组成的稀溶液中构成原电池,则负极的电极反应式为________.
(3)常温下,ACD3的稀溶液与CA3的水溶液混合,可能出现的结果是________.
①pH<7,c(H+)>c(CD![]() )>c(OH-)>c(CA
)>c(OH-)>c(CA![]() )
)
②pH<7,c(CD![]() )>c(OH-)=c(H+)>c(CA
)>c(OH-)=c(H+)>c(CA![]() )
)
③①pH>7,c(CA![]() )>c(OH-)>c(CD
)>c(OH-)>c(CD![]() )>c(H+)
)>c(H+)
④①pH<=7,c(CA![]() )>c(CD
)>c(CD![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
(4)对可逆反应3A2(g)+C2(g)![]() 2CA3(g),当反应达到平衡时,不断改变条件(不改变A2、C2、CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是________.
2CA3(g),当反应达到平衡时,不断改变条件(不改变A2、C2、CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是________.
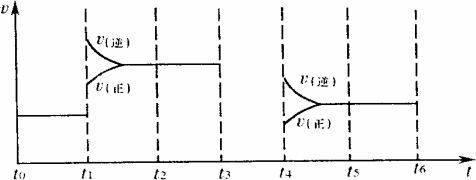
(5)温度为T℃时,将4 amol A2和2 amol C2放入1 L密闭容器中,充分反应后测得C2的转化率为50%,则该反应的平衡常数为________.




 HClO+OH-
HClO+OH- HClO+OH-
HClO+OH-

| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com