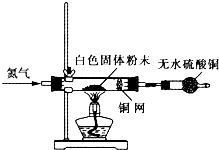
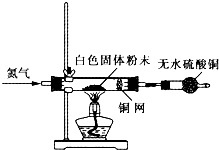
在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
方法甲:取2药匙细小的硫酸铜晶体置于
研钵
研钵
中研碎后放入坩埚,将坩埚放在
泥三角
泥三角
上用小火慢慢加热并用玻璃棒不停搅拌,最后将坩埚移入
干燥器
干燥器
中进行冷却(请选用合适仪器或设备填空:表面皿、研钵、烧杯、通风橱、试管夹、干燥器、泥三角).
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20ml浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干.
交流与讨论:
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是
CuSO
4?5H
2O
CuO+SO
3+5H
2O或CuSO
4?5H
2O
CuO+H
2SO
4+4H
2O
CuSO
4?5H
2O
CuO+SO
3+5H
2O或CuSO
4?5H
2O
CuO+H
2SO
4+4H
2O
(用化学方程式表示);
(2)方法乙中,浓硫酸的作用是
吸水剂
吸水剂
,为了不浪费药品,对无水乙醇洗涤液进行再生的方法是
加CaO后蒸馏
加CaO后蒸馏
,所用的主要玻璃仪器有蒸馏烧瓶、温度计、承接管(牛角管)、锥形瓶
酒精灯、冷凝管
酒精灯、冷凝管
等;
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想
铜离子(或硫酸铜)对双氧水分解有催化作用
铜离子(或硫酸铜)对双氧水分解有催化作用
;
(4)目前工业上正积极探索用浓HNO
3作氧化剂,用Cu与浓H
2SO
4、浓HNO
3反应,采取间歇加热、逐渐加入浓HNO
3的方法来制备CuSO
4?5H
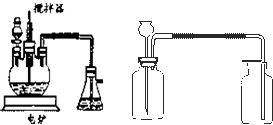
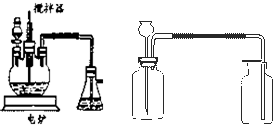
2O 的新工艺.模拟制备装置如图所示.
问题一如图装置中,分液漏斗内装的液体是
浓硝酸
浓硝酸
;反应结束时,获取CuSO
4?5H
2O的操作过程是先
先撤去导管
先撤去导管
,后
停止加热
停止加热
;趁热将三颈瓶中的液体倒入烧杯中冷却,析出晶体CuSO
4?5H
2O,过滤、晾干;
问题二工业上用石灰乳吸收尾气,除了防止环境污染外,还能得到了有经济实用价值的副产品----亚硝酸钙.尾气吸收生成亚硝酸钙的化学方程式是:
NO2+NO+Ca(OH)2=Ca(NO2)2+H2O 或4NO2+2Ca(OH)2=Ca(NO3)2+Ca(NO2)2+2H2O
NO2+NO+Ca(OH)2=Ca(NO2)2+H2O 或4NO2+2Ca(OH)2=Ca(NO3)2+Ca(NO2)2+2H2O
;
问题三将石灰乳稀释,可得到澄清石灰水. 澄清石灰水与CO
2相遇能够产生白色沉淀.某同学想用如图所示装置以大理石和稀盐酸反应制取CO
2.教师指出制取等量的气体,该装置需要太多的盐酸,造成浪费.该同学对该装置某部位加了一个小试管,解决了这个问题.请你把改进画在图中合适的位置.
.

 在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.

 在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.