
题目列表(包括答案和解析)
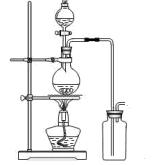
(14分)某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验,甲同学设计了如图所示的实验装置。
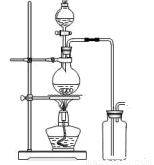
A B
(1)写出制取氯气反应的离子方程式 __________________________;装置中使用分液漏斗而不使用长颈漏斗的原因是_______________________________________
_____________________________________________________________________;
实验时为了除去氯气中的氯化氢气体,最好在A、B之间安装盛有 试剂的净化装置。
(2)若用含有0、2molHCl的MnO2反应制氯气,制得Cl2体积(标准状况下)总是小于1、12L的原因 。
(3)已知:H2CO3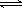 H++HCO3-
Ka1 =4.45×10-7
H++HCO3-
Ka1 =4.45×10-7
HCO3-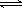 H++CO32-
Ka2=5.61×10-11
H++CO32-
Ka2=5.61×10-11
HClO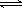 H++ClO-
Ka=2.95×10-8
H++ClO-
Ka=2.95×10-8
请根据以上碳酸和次氯酸的电离常数,写出下列条件下发生反应的离子方程式:①将少量氯气通入过量的碳酸钠溶液中______________________________。
⑷乙同学认为甲同学的实验有缺陷,提出在 位置后(填字母)增加一个装置,该装置中应加入 试剂,其作用 。
某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验,甲同学设计了如图所示的实验装置。
A B
(1)写出制取氯气反应的离子方程式 __________________________;装置中使用分液漏斗而不使用长颈漏斗的原因是_______________________________________
_____________________________________________________________________;
实验时为了除去氯气中的氯化氢气体,最好在A、B之间安装盛有 试剂的净化装置。
(2)若用含有0、2molHCl的MnO2反应制氯气,制得Cl2体积(标准状况下)总是小于1、12L的原因 。
(3)已知:H2CO3![]() H++HCO3- Ka1 =4.45×10-7
H++HCO3- Ka1 =4.45×10-7
HCO3-![]() H++CO32- Ka2=5.61×10-11
H++CO32- Ka2=5.61×10-11
HClO![]() H++ClO- Ka=2.95×10-8
H++ClO- Ka=2.95×10-8
请根据以上碳酸和次氯酸的电离常数,写出下列条件下发生反应的离子方程式:①将少量氯气通入过量的碳酸钠溶液中______________________________。
⑷乙同学认为甲同学的实验有缺陷,提出在 位置后(填字母)增加一个装置,该装置中应加入 试剂,其作用 。
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
| ||
| ||
| ||
| ||
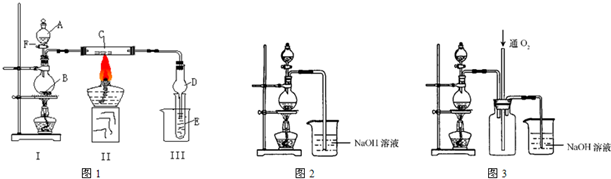
如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源正极.
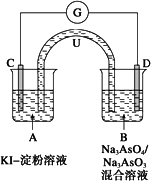
(1)As(砷)位于元素周期表中第4周期ⅤA族,则Na3AsO4溶液的pH________(填“>7”、“<7”或“=7”).
(2)向B杯中加入适量较浓的硫酸,发现G的指针向右偏移.此时A杯中的主要实验现象是________,D电极上的电极反应式为________.
(3)一段时间后,再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移.此时整套实验装置的总的离子方程式为________.
(4)再过一段时间后,G的指针逐渐归零,此时实验装置中的化学反应已经达到化学平衡状态,该反应的化学平衡常数的表达式为K=________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com